Основы молекулярной физики и термодинамики. Молекулярно-кинетическая теория газов. Законы идеальных газов. Молекулярная физика и термодинамика Вопросы по молекулярной физике и термодинамике
ОСНОВЫ МОЛЕКУЛЯРНОЙ ФИЗИКИ И ТЕРМОДИНАМИКИ
Статистический и т/д методы исследования .
Молекулярная физика и термодинамика - разделы физики, в которых изучаются макроскопические процессы в телах, связанные с огромным числом содержащихся в телах атомов и молекул.
Молекулярная физика представляет собой раздел физики, изучающий строение и свойства веществ, исходя из так называемых молекулярно-кинетических представлений. Согласно этим представлениям:
1. Любое тело - твердое, жидкое или газообразное состоит из большого количества весьма малых обособленных частиц-молекул.
2. Молекулы всякого вещества находятся в бесконечном хаотическом движении (например, броуновское движение).
3. Используется идеализированная модель идеального газа, согласно которой:
а). Собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда (разреженность).
б). Между молекулами отсутствуют силы взаимодействия.
в). Столкновение молекул газа между собой и со стенками сосуда абсолютно упругие.
4. Макроскопические свойства тел (давление, температура и др.) описываются с помощью статистических методов, основным понятием которых является статистический ансамбль, т.е. описывается поведения большого числа частиц через введение средних характеристик (средняя скорость, энергия) всего ансамбля, а не отдельной частицы.
Термодинамика в отличие от молекулярно-кинетической теории изучает макроскопические свойства тел, не интересуясь их макроскопической картиной.
Термодинамика - раздел физики, изучающий общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями.
В основе термодинамики лежат 3 фундаментальных закона, называемых началами термодинамики, установленных на основании обобщения большой совокупности опытных фактов.
Молекулярно-кинетическая теория и термодинамика взаимно дополняют друг друга, образуя единое целое, но отличаясь различными методами исследования.
Термодинамическая система - совокупность макроскопических тел, которые взаимодействуют и обмениваются энергией как между собой, так и с другими телами. Состояние системы задается термодинамическими параметрами - совокупность физических величин, характеризующих свойства термодинамической системы, обычно в качестве параметров состояния выбирающих температуру, давление и удельный объем.
Температура - физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы.
[ T ] = K - термодинамическая шкала, [ t ] = ° C - международная практическая шкала. Связь термодинамической и м/н практической температуры: Т = t + 273, например, при t = 20 ° C T = 293 K .
Удельный обьем - это обьем единицы массы. Когда тело однородно т. е. ρ = const , то макроскопические свойства однородного тела могут характеризовать обьем тела V .
Молекулярно-кинетическая теория (м. к. т) идеальных газов.
§1 Закон идеальных газов .
В молекулярно - кинетической теории используется идеализированная модель идеального газа.
Идеальным газом называется газ, молекулы которого не взаимодействуют друг с другом на расстоянии и имеют ничтожно малые собственные размеры.
У реальных газов молекулы испытывают действия силы межмолекулярного взаимодействия. Однако H 2, He , O 2, N 2 при н. у. (Т=273К, Р=1,01 ·10 5 Па) можно приблизительно считать идеальным газом.
Процесс, при котором один из параметров (p , V , T , S ) остаются постоянными, называются изопроцессами.
- Изотермический процесс Т= const , m = const , описываются законом Бойля-Мариотта :
pV = const
- Изобарический процес p = const описывается законом Гей-Люссака
V = V 0 (1+ α t );
V = V 0 α T
Терметический коэффициент обьемного расширения град -1

- Изохорический процесс V = const
 Описывается законом Шарля
Описывается законом Шарля
p = p 0 (1+ α t );
p = p 0 α T
Характеризует зависимость объёма от температуры. α равен относительному изменению объёма газа при нагревании его на 1 К. Как показывает опыт, одинаков для всех газов и равен .
4. Моль вещества. Число Авогадро. Закон Авогадро.
Атомной массой () химического элемента называется отношение массы атома этого элемента к 1/12 массы атома изотопа углерода С 12
2.1. Основные понятия молекулярной физики и термодинамики
Молекулярная физика - раздел физики, в котором изучаются физические свойства и строение вещества в различных агрегатных состояниях на основе их микроскопического (молекулярного) строения.
Молекулярно-кинетическая теория строения вещества - раздел молекулярной физики, в котором изучаются свойства тел на основе представлений об их молекулярном строении.
Статистическая физика – раздел молекулярной физики, в котором изучаются свойства и движения не отдельных молекул (частиц), а совокупности частиц, характеризующиеся средними величинами.
Термодинамика – наука, в которой изучаются свойства физических систем вне связи с их микроскопическим строением.
Система – совокупность рассматриваемых тел (в частности: молекул, атомов, частиц).
Параметры состояния системы: p-давление, V- объём, T-температура.
а) Интенсивные параметры - параметры (давление, температура, концентрация и др.), не зависящие от массы системы.
Температура - физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы. Свойство температуры - определять направление теплового обмена. Температура в молекулярной физике определяет распределение частиц по уровням энергии и распределение частиц по скоростям.
Термодинамическая температурная шкала - температурная шкала, определяемая температура (абсолютная температура) в которой всегда положительна.
б) Экстенсивные параметры - параметры (объем, внутренняя энергия, энтропия и др.), значения которых пропорциональны массе термодинамической системы или ее объему.
Внутренняя энергия системы - суммарная кинетическая энергия хаотического движения молекул, потенциальная энергия их взаимодействия и внутримолекулярная энергия, т.е. энергия системы без учёта кинетической энергии её в целом (при движении) и потенциальной энергии во внешнем поле.
Изменение внутренней энергии при переходе системы из состояния в состояние равно разности значений внутренней энергии в этих состояниях и не зависит от пути перехода системы из одного состояния в другое.
Уравнение состояния системы:
F(p,V,T) = 0. (2.1)
Неравновесное состояние системы – такое, при котором какой-либо из ее параметров состояния системы изменяется.
Равновесное состояние системы - такое, при котором все параметры состояния системы имеют определённые значения, постоянные при неизменных внешних условиях.
Время релаксации - время, в течение которого система приходит в равновесное состояние.
Процесс – переход системы из одного состояния в другое состояние, связанный с изменением хотя бы одного из ее параметров состояния:
а) обратимый процесс - процесс, при котором возможно осуществить обратный переход системы из конечного в начальное состояние через те же промежуточные состояния так, чтобы не осталось никаких изменений в окружающей систему среде;
б) необратимый процесс - процесс, при котором невозможно осуществить обратный переход системы в первоначальное состояние, или если по окончании процесса в окружающей среде или в самой системе произошли какие-либо изменения;
в) круговой процесс (цикл) - такая последовательность превращений, в результате которой система, выйдя из какого-либо исходного состояния, возвращается в него вновь. Любой круговой процесс состоит из процессов расширения и сжатия. Процесс расширения сопровождается работой, совершаемой системой, а процесс сжатия - работой, совершаемой над системой внешними силами. Разность этих работ равна работе данного цикла.
Динамические закономерности - закономерности, подчиняющиеся системам уравнений (в том числе дифференциальных, интегральных и др.), допускающих существование единственного решения для каждого начального условия.
Статистические закономерности - количественные закономерности, устанавливаемые статистическим методом, в котором рассматриваются лишь средние значения величин, характеризующих данную совокупность молекул (рассматривается конкретная молекулярная модель, и к ней применяются математические методы статистики, основанные на теории вероятностей).
Вероятность термодинамическая - число способов, которыми может быть реализовано данное состояние макроскопической физической системы (предел, к которому стремится относительная частота появления некоторого события при достаточно большом, стремящемся к бесконечности числе повторений опыта при неизменных внешних условиях):
w = n/N, (2.2)
где N - число опытов;
n - число раз получено определенное событие.
Флуктуации - случайные отклонения физических величин от их среднего значения.
Молекула - наименьшая часть вещества, обладающая его основными химическими свойствами и состоящая из атомов, соединенных между собой химическими связями.
Атом - часть вещества микроскопических размеров (микрочастица), наименьшая частица химического элемента, обладающая его свойствами. Атомы в разных сочетаниях входят в состав молекул разных веществ.
Относительная атомная масса - отношение массы данного атома к 1/12 массы изотопа углерода с массовым числом 12 (12 С).
Относительная молекулярная масса - отношение массы данной молекулы к 1/12 массы атома 12 С.
Моль - количество вещества, в котором содержится число частиц (атомов, молекул и других частиц), равное числу атомов в 0,012 кг изотопа углерода С 12 .
Число Авогадро - число атомов или молекул в моле любого вещества: N А = 6,0210 23 моль -1 .
Молярная масса - масса вещества, взятого в количестве одного моля:
= m 0 N А. (2.3)
2.2. Основные представления и законы молекулярно-кинетической теории
Идеальный газ - теоретическая модель газа, в которой не учитывается взаимодействие его частиц (средняя кинетическая энергия частиц много больше энергии их взаимодействия). Размеры молекул идеального газа малы по сравнению с расстояниями между ними. Суммарный собственный объем молекул такого газа мал по сравнению с объемом сосуда. Силы взаимодействия между молекулами настолько малы, что движение молекул от столкновения до столкновения происходит по прямолинейным отрезкам. Число ежесекундных столкновений молекул велико.
Основные положения молекулярно-кинетической теории идеального газа :
1) газ состоит из мельчайших частиц - атомов или молекул, находящихся в непрерывном движении;
2) в любом, даже очень малом объёме, к которому применимы выводы молекулярно-кинетической теории, число молекул очень велико;
3) размеры молекул малы по сравнению с расстояниями между ними;
4) молекулы газа свободно движутся между двумя последовательными взаимодействиями друг с другом или со стенками сосуда, в котором он находится. Силы взаимодействия между молекулами, кроме моментов соударения, пренебрежимо малы. Соударения молекул происходят без потерь механической энергии, т.е. по закону абсолютно упругого взаимодействия;
5) при отсутствии внешних сил молекулы газа распределяются равномерно по всему объёму;
Основное уравнение молекулярно-кинетической теории газов:
где
 - средняя квадратичная скорость.
- средняя квадратичная скорость.
Основное уравнение молекулярно-кинетической теории газов для давления:
 ,
,
 , (2.5)
, (2.5)
где n 0 = N " /V - число молекул в единице объема;
 -
средняя кинетическая энергия
поступательного движения молекул газа;
-
средняя кинетическая энергия
поступательного движения молекул газа;
k - постоянная Больцмана.
Закон Авогадро : в одинаковых объемах при одинаковых температурах и давлениях содержатся одинаковые количества молекул.
Закон Дальтона: давление смеси газов равно сумме парциальных давлений, т.е. тех давлений, которые имел бы каждый из входящих в смесь газов, если бы в объеме, занятом смесью, находился он один:
Уравнение состояния идеальных газов для произвольной массы m (уравнение Менделева-Клапейрона) :
 ,
(2.7)
,
(2.7)
где R - газовая постоянная, которая численно равна работе расширения одного моля газа при его нагревании на один градус в условиях постоянного давления;
T - абсолютная температура.
Степени свободы i - число независимых координат, необходимых для полного описания положения системы в пространстве. Все степени свободы равноправны.
Общее число степеней свободы
 (2.8)
(2.8)
где
 - число степеней свободы поступательного
движения;
- число степеней свободы поступательного
движения;
 -
число степеней свободы вращательного
движения;
-
число степеней свободы вращательного
движения;
 -
число степеней свободы колебательного
движения;
-
число степеней свободы колебательного
движения;
i кп - число степеней свободы колебаний точки при поступательном движении;
i квр - число степеней свободы колебаний точки при вращательном движении.
Молекулы газа имеют число степеней свободы:
а) одноатомная - i = 3 (три степени свободы поступательного движения);
б) двухатомная при упругой связи между атомами - i = 6;
в) двухатомная при жёсткой связи между атомами - i = 5;
г) трёхатомная молекула при жёсткой связи между атомами - i = 6.
Теорема
о равномерном распределении энергии
по степеням свободы:
на любую степень свободы приходится в
среднем одинаковая энергия, равная
 ,
а молекула, обладающаяi
степенями свободы, обладает энергией
,
а молекула, обладающаяi
степенями свободы, обладает энергией
 (2.9)
(2.9)
где i = i п + i вр + i к.
Внутренняя энергия произвольной массы газа m складывается из энергии отдельных молекул:
 ,
(2.10)
,
(2.10)
где - молярная масса газа.
Теплоемкость - физическая величина, численно равная количеству теплоты, которое необходимо сообщить веществу для нагревания его на один градус.
Удельная теплоёмкость " c " - физическая величина, численно равная количеству теплоты, которое необходимо сообщить единице массы вещества для нагревания её на один градус.
Молярная теплоёмкость " C " - физическая величина, численно равная количеству теплоты, которое необходимо сообщить одному молю вещества, чтобы увеличить его температуру на один градус:
 .
(2.11)
.
(2.11)
Удельная теплоёмкость при постоянном объеме" c v " - физическая величина, численно равная количеству теплоты, которое необходимо сообщить единице массы вещества для нагревания её на один градус в условиях постоянного объема:
 (2.12)
(2.12)
Удельная теплоёмкость при постоянном давлении " c p " - физическая величина, численно равная количеству теплоты, которое необходимо сообщить единице массы вещества для нагревания её на один градус в условиях постоянного давления:
 .
(2.13)
.
(2.13)
Молярная теплоёмкость при постоянном объеме " C v " - физическая величина, численно равная количеству теплоты, которое необходимо сообщить одному молю вещества, чтобы увеличить его температуру на один градус в условиях постоянного объема:
 .
.
 .
(2.14)
.
(2.14)
Молярная теплоёмкость при постоянном давлении " C p " - физическая величина, численно равная количеству теплоты, которое необходимо сообщить одному молю вещества, чтобы увеличить его температуру на один градус в условиях постоянного давления:
 ,
,
 .
(2.15)
.
(2.15)
Отношение молярных и удельных теплоемкостей :
Средняя квадратичная скорость молекул (для газа массой "m", находящегося в состоянии равновесия, при T = const) остаётся постоянной:
 или
или
 , (2.17)
, (2.17)
где N i - число молекул, обладающих скоростью v i ;
N - число всех молекул.
Наиболее вероятная скорость - скорость движения молекул, которая характеризует положение максимума функции распределения Максвелла:
 (2.18)
(2.18)
Средняя арифметическая скорость
 (2.19)
(2.19)
Относительная скорость применяется для расчета числа молекул, движущихся со скоростями в интервале от v до v + dv:
u = v/v в. (2.20)
Закон распределения молекул идеального газа по скоростям в стационарном состоянии (распределение Максвелла):
 (2.21)
(2.21)
где dn v - среднее число молекул в единице объема со скоростями в интервале от v до v + dv;
n - число молекул в единице объема.
Функция распределения (доля молекул от их общего числа отнесена к некоторому интервалу скоростей):
 или
или
 ,
(2.22)
,
(2.22)
где dn v /ndv - функция распределения.
Свободные пробеги молекул - прямолинейные участки траектории, проходимые молекулой между двумя последовательными соударениями.
Средняя длина свободного пробега молекулы – среднее расстояние, проходимое молекулой между двумя соударениями:
 (2.23)
(2.23)
где Z - число соударений;
v - средняя скорость молекулы;
k - постоянная Больцмана;
d - диаметр молекулы;
p - давление;
T - абсолютная температура.
Среднее
число соударений
- число соударений молекул
 ,
(2.24)
,
(2.24)
Эффективный диаметр молекулы d - минимальное расстояние, на которое сближаются при столкновении центры 2-х молекул.
Эффективное сечение - величина равная
= d 2 . (2.25)
Барометрическая формула показывает, что давление убывает с высотой тем быстрее, чем тяжелее газ и чем ниже его температура:
(2.26)
Закон распределения молекул газа по высоте в поле сил тяготения (распределение Больцмана):
где n o - число молекул в единице объема в том месте, где потенциальная энергия молекул равна нулю;
n - число молекул в единице объема в тех точках пространства, где потенциальная энергия молекул равна W p .
Распределение Максвелла-Больцмана - благодаря этому распределению можно определить долю молекул идеального газа, имеющих скорости в интервале от v до v + dv и обладающих потенциалом = gh во внешнем силовом поле:
 ,
(2.28)
,
(2.28)
где v в - наиболее вероятная скорость, значению которой соответствует максимум кривой Максвелла.
Зависимость плотности газа от высоты:
где m o - масса одной молекулы.
2.3. Основные положения и законы термодинамики
Первое начало термодинамики - закон сохранения и превращения энергии, которым сопровождаются термодинамические процессы – количество тепла, подводимого к системе, идет на изменение ее внутренней энергии и работу, производимую системой против внешних сил:
 , (2.30)
, (2.30)
где dU - изменение внутренней энергии системы;
Q - элементарное количество тепла, подводимого к системе;
A - элементарная работа, совершаемая системой.
Изотермический
процесс
-
процесс, протекающий при постоянной
температуре (T
= const).
При изотермическом процессе все
подводимое к системе тепло идет на
совершение этой системой работы
 ,
при этом dU
= C v dT
= 0,
,
при этом dU
= C v dT
= 0,
а U = = const.
m идеального газа при изотермическом процессе:
 .
(2.31)
.
(2.31)
Изобарический процесс – процесс, протекающий при постоянном давлении (p = const). При этом подводимое к системе тепло идет как на изменение ее внутренней энергии, так и на совершение этой системой работы:
Работа, совершаемая произвольной массой m
 . (2.33)
. (2.33)
Изменение внутренней энергии произвольной массы m идеального газа при изобарическом процессе:
 .
(2.34)
.
(2.34)
Изохорический процесс – процесс, протекающий при постоянном объеме (V = const). При этом все подводимое к системе тепло идет на изменение ее внутренней энергии:
 ,
,
 (2.35)
(2.35)
Адиабатический процесс - процесс, протекающий без теплообмена или почти без теплообмена с окружающей средой. При этом работа может совершаться системой только за счет убыли ее внутренней энергии:
 ,
,
 .
(2.36)
.
(2.36)
Уравнения адиабатического процесса (уравнения Пуассона):

 ;
;
 . (2.37)
. (2.37)
Работа, совершаемая произвольной массой m идеального газа при адиабатическом расширении:
 .
(2.38)
.
(2.38)
Политропический процесс - такой процесс, при котором p и V связаны соотношением:
 , (2.39)
, (2.39)
где n - показатель политропы, принимающий любые значения от - до + . В частности для изобарического процесса n = 0, изотермического - n = 1, адиабатического - n = , изохорического - n = .
Работа, совершаемая произвольной массой m идеального газа при политропическом процессе:
 (2.40)
(2.40)
Работа, совершаемая идеальным газом при круговом процессе, равна разности работ при расширении А 1 и при сжатии А 2 газа и эквивалентна разности количеств тепла, подводимого к системе при расширении Q 1 и отводимого от нее при сжатии Q 2 :
Коэффициент полезного действия кругового процесса (цикла) - физическая величина, равная отношению работы цикла к работе, которую можно было бы совершить при превращении в нее всего количества тепла, подведенного к системе:
 (2.42)
(2.42)
Цикл Карно - цикл, состоящий из двух изотермических и двух адиабатических процессов.
Работа, совершаемая произвольной массой m идеального газа в цикле Карно, - разность между работой, совершенной системой при расширении, и работой, совершенной над системой при ее сжатии:
 .
(2.43)
.
(2.43)
Коэффициент полезного действия цикла Карно не зависит от природы вещества, а зависит лишь от температур, при которых теплота сообщается системе и отбирается от нее:
 .
(2.44)
.
(2.44)
Коэффициент полезного действия холодильной машины (холодильника):
 (2.45)
(2.45)
Цикл Отто состоит из двух адиабат и двух изохор.
Цикл Дизеля состоит из двух адиабат, изохоры и изобары.
Энтропия - физическая величина, элементарное изменение которой при переходе системы из одного состояния в другое равно полученному или отданному количеству теплоты, деленному на температуру, при которой произошел этот процесс:
 .
(2.46)
.
(2.46)
Связь энтропии системы с термодинамической вероятностью (соотношение Больцмана):
S = kln w, (2.47)
где k - постоянная Больцмана.
переходе из одного состояния в другое
 .
(2.48)
.
(2.48)
Изменение энтропии системы при переходе из одного состояния в другое:
Изменение энтропии системы при изотермическом процессе:
 . (2.50)
. (2.50)
Изменение энтропии системы при изобарическом процессе:
Изменение энтропии системы при изохорическом процессе:
 .
(2.52)
.
(2.52)
Изменение энтропии системы при адиабатическом процессе:
S
= 0,
 .
(2.53)
.
(2.53)
Изменение энтропии системы, совершающей цикл Карно:
 ,
(2.54)
,
(2.54)
где S р - изменение энтропии рабочего тела;
S н, S х - изменение энтропии нагревателя и холодильника;
S пр - изменение энтропии "потребителя работы".
В случае совершения системой обратимого цикла Карно энтропия замкнутой системы не изменяется:
S обр = 0 или S обр =const. (2.55)
В случае совершения системой необратимого цикла Карно энтропия замкнутой системы возрастает:
S
0;
 ;
;
 .
(2.56)
.
(2.56)
Для произвольных процессов, происходящих в замкнутой системе, энтропия системы для любых происходящих в ней процессов не может убывать:
S
0 или
 , (2.57)
, (2.57)
где знак равенства справедлив для обратимых процессов, а знак неравенства - для необратимых.
Второе начало термодинамики: в изолированной системе возможны только такие процессы, при которых энтропия системы возрастает или невозможен процесс, единственным результатом которого является превращение в работу теплоты, полученной от нагревателя:
Термодинамические потенциалы - определенные функции объема V, давления p, температуры T, энтропии S, числа частиц системы N и других макроскопических параметров x, характеризующих состояние термодинамической системы:
а) внутренняя энергия - энергия системы, зависящая от ее внутреннего состояния. Она является однозначной функцией независимых переменных, определяющих это состояние, например температуры T и объема V (или давления p):
U = U(S,V,N,x). (2.59)
Изменение внутренней энергии системы U определяется лишь ее значениями в начальном и конечном состояниях:
 .
(2.60)
.
(2.60)
б) энтальпия (теплосодержание) характеризует состояние макроскопической системы в термодинамическом равновесии при выборе в качестве основных независимых переменных энтропии S и давления p:
H = H(S,p,N,x). (2.61)
Энтальпия системы равна сумме энтальпий составляющих ее частей.
Связь энтальпии с внутренней энергией U системы:
 ,
(2.62)
,
(2.62)
где V - объем системы.
Полный дифференциал энтальпии (при неизменных N и x ) имеет вид
 .
(2.63)
.
(2.63)
Связь энтальпии с температурой, объемом и теплоемкостью (при постоянном давлении) системы:
 ;
;
 ;
C p =(dH/dt).
(2.64)
;
C p =(dH/dt).
(2.64)
Изменение энтальпии ( H ) равно количеству теплоты, которое сообщают системе или отводят от нее при постоянном давлении, поэтому значения H характеризуют тепловые эффекты фазовых переходов (плавления, кипения и т. д.), химических реакций и других процессов, протекающих при постоянном давлении.
в) свободная энергия - одно из названий изохорно-изотермического термодинамического потенциала или Гельмгольца энергии. Представляет собой ту часть внутренней энергии системы, которая превращается во внешнюю работу при обратимых изотермических процессах F = F(V,T,N,x):
где TS - связанная энергия.
Связанная энергия представляет собой ту часть внутренней энергии, которая не может быть передана в виде работы при изотермическом процессе:
TS = U - F. (2.66)
Изменение (уменьшение) свободной энергии при необратимых изотермических процессах определяет наибольшую величину работы, которую может совершить система:
 ;
;
 .
(2.67)
.
(2.67)
г) энергия Гиббса - изобарно-изотермический потенциал, свободная энтальпия, характеристическая функция термодинамической системы при независимых параметрах p, T и N - G. В изотермически равновесном процессе, при постоянном давлении, убыль энергии Гиббса системы равна полной работе системы за вычетом работы против внешнего давления (т.е. равна максимальному значению "полезной" работы):
G
= G(p,T,N,x);
 .
(2.68)
.
(2.68)
Связь энергии Гиббса со свободной энергией:
 .
(2.69)
.
(2.69)
д) химический потенциал - физическая величина, равная энергии Гиббса отдельно взятой частицы.
Третье начало термодинамики (теорема Нернста): изменение энтропии системы (S) при любых обратимых изотермических процессах, совершаемых между двумя равновесными состояниями при температурах, приближающихся к абсолютному нулю, стремится к нулю. При помощи последовательности термодинамических процессов нельзя достичь температуры, равной абсолютному нулю:
 .
(2.70)
.
(2.70)
Термодинамика неравновесных процессов - общая теория макроскопического описания неравновесных процессов. Основная задача термодинамики неравновесных процессов - количественное изучение этих процессов для состояний, не сильно отличающихся от равновесного состояния.
Закон сохранения массы:
 , (2.71)
, (2.71)
где - плотность многокомпонентной системы;
v - гидродинамическая скорость среды (средняя скорость переноса массы), зависящая от координат и времени;
∙v - поток массы.
Закон
сохранения массы для концентрации
какого-либо компонента
 :
:
 ,
(2.72)
,
(2.72)
где c k - концентрация компонента;
k - плотность компонента;
- плотность среды;
J k = k (v k - v) - диффузионный поток;
v k - гидродинамическая скорость (средняя скорость переноса массы) компонента.
Закон сохранения импульса: изменение импульса элементарного объема может происходить за счет сил, вызванных градиентом внутренних напряжений в среде P , , и внешних сил F k .
Закон сохранения энергии представляет собой первое начало термодинамики в термодинамике неравновесных процессов.
Уравнение баланса энтропии: в термодинамике неравновесных процессов принимается, что энтропия элементарного объема является такой же функцией от внутренней энергии, удельного объема и концентрации, как и в состоянии полного равновесия:
 ,
(2.73)
,
(2.73)
где - скорость возрастания энтропии;
- плотность вещества;
s – энтропия элементарного объема (локальная энтропия);
J s – плотность потока энтропии.
2.4. Реальные газы. Фазовые равновесия и превращения
Реальный газ – газ, свойства которого зависят от взаимодействия частиц и их собственного объема, что особенно проявляется при высоких давлениях и низких температурах.
Уравнение состояния реальных газов (уравнение Ван дер Ваальса) для произвольной массы газа :
 , (2.74)
, (2.74)
где "а" - поправка Ван дер Ваальса на влияние сил межмолекулярного взаимодействия (на внутреннее давление);
"в" - поправка Ван дер Ваальса на собственный объем молекул;
μ - молекулярная масса газа;
m - масса газа.
Внутренняя энергия реального газа состоит из кинетической энергии поступательного и вращательного движения молекул Е k и потенциальной энергии их взаимодействия Е p .
Потенциальная энергия взаимодействия одного моля молекул реального газа имеет отрицательный знак, т.к. молекулярные силы, создающие внутреннее давление p " , являются силами притяжения:
 .
(2.75)
.
(2.75)
Изменение потенциальной энергии реального газа (для моля) равно работе, которую совершает внутреннее давление p при расширении газа от объёма V 1 до V 2:
 .
(2.76)
.
(2.76)
Кинетическая энергия молекул реального газа (для моля) согласно теореме о равном распределении энергии по степеням свободы (в некотором приближении):
 .
(2.77)
.
(2.77)
Внутренняя энергия одного моля реального газа:
 .
(2.78)
.
(2.78)
Изменение температуры реального газа при адиабатическом расширении (при этом газ охлаждается) или сжатии (при этом газ нагревается) :
 .
(2.79)
.
(2.79)
Эффект Джоуля - Томсона - изменение температуры реального газа при расширении через пористую перегородку. Если газ при расширении охлаждается, то эффект Джоуля-Томсона называется положительным, если нагревается - отрицательным.
Фаза - равновесное (в термодинамике) состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества.
Фазовые превращения - переход вещества из одной фазы в другую, связанный с качественными изменениями свойств вещества при изменении внешних условий.
Фазовое равновесие - одновременное существование термодинамически равновесных фаз в многофазной системе.
Правило фаз Гиббса: в веществе, состоящем из n компонентов, одновременно может существовать не более чем (n + 2) равновесных фаз.
Число физических параметров системы, которые можно изменять, не нарушая фазовое равновесие:
L = n + 2 - , (2.80)
где - число фаз, находящихся в равновесии.
Уравнение Клапейрона-Клаузиуса определяет изменение температуры фазового перехода при бесконечно малом изменении давления:
 ;
;
 ;
; ,
(2.81)
,
(2.81)
где Q - теплота фазового перехода;
T - температура перехода;
dp/dT - производная от давления по температуре;
dT/dp - производная от температуре по давлению;
(V 2 - V 1) - изменение объема вещества при переходе его из первой фазы во вторую.
Метастабильное состояние - состояние неустойчивого равновесия физической макроскопической системы (фазы). В таком состоянии система может находиться длительное время, не переходя в более устойчивое (при данных условиях) состояние (фазу).
Линии (поверхности) равновесия фаз - графики, изображающие зависимость одних термодинамических переменных от других в условиях фазового равновесия.
Диаграммы состояния - совокупность линий (поверхностей) равновесия фаз.
Тройная точка - точка пересечения одной линии (поверхности) равновесия фаз с другой.
Критическая точка - точка на диаграмме состояния, соответствующая критическому состоянию вещества. Состояние вещества в критической точке характеризуется критическими значениями температуры T k , давления p k и объема V k .
Критическая точка в случае двухфазного равновесия - точка окончания линии (поверхности) равновесия фаз.
Точка перехода - значение температуры, давления или какой-либо другой величины, при которой происходит фазовый переход.
Фазовый переход первого рода характеризуется тем, что при его осуществлении поглощается или выделяется определенное количество теплоты, которое называют теплотой фазового перехода. Значение таких термодинамических величин вещества, как плотность, концентрация компонентов, изменяется скачком.
Фазовый переход второго рода - такой переход, при котором некоторая физическая величина, равная нулю с одной стороны от точки перехода, постепенно растет при удалении от точки перехода в другую сторону, при этом плотность вещества изменяется непрерывно и не происходит поглощения или выделения тепла.
2.5. Кинетические явления (явления переноса)
Кинетические явления (явления переноса) - необратимые процессы, сопровождающиеся переносом какой-либо физической величины, в результате перехода любой системы из неравновесного состояния в равновесное состояние.
Кинетические явления в молекулярной физике - вязкость, теплопроводность, диффузия.
Вязкость (внутреннее трение) - явление переноса, в результате которого происходит перенос количества движения (импульса) молекул из одного слоя газа или жидкости в другой.
Сила внутреннего трения в жидкости или газе определяется по формуле Ньютона:
 ,
(2.82)
,
(2.82)
где - коэффициент вязкости;
S - площадь соприкасающихся слоев жидкости или газа;
dv/dz - градиент скорости течения жидкости или газа в направлении, перпендикулярном направлению течения;
Коэффициент динамической вязкости - физическая величина, численно равная силе внутреннего трения между двумя слоями жидкости или газа единичной площади при градиенте скорости, равном единице:
 или
или
 ,
(2.83)
,
(2.83)
где n 0 - число молекул в единице объема;
u - средняя скорость теплового движения молекул;
m - масса молекулы;
- средняя длина свободного пробега молекул;
= n 0 ∙m - плотность жидкости или газа.
Коэффициент кинематической вязкости - отношение динамической вязкости к плотности вещества:
ν = η/ρ. (2.84)
Диффузия - процесс взаимного проникновения молекул (атомов) постороннего вещества, обусловленный их тепловым движением. Диффузия всегда сопровождается переносом массы вещества. Она характерна для газов, жидкостей и твердых тел.
Самодиффузия - процесс взаимного проникновения собственных молекул (атомов), обусловленный их тепловым движением.
Закон диффузии (первый закон Фика) :
 ,
(2.85)
,
(2.85)
где D - коэффициент диффузии;
dс/dz - скорость изменения (градиент) концентрации в направлении z;
"минус" - показывает, что масса переносится в направлении убывания концентрации данной компоненты.
Коэффициент диффузии - физическая величина, числено равная массе переносимого вещества через единичную площадку в единицу времени при градиенте концентрации, равном единице:
 ,
(2.86)
,
(2.86)
где
<> - средняя длина свободного пробега молекул.
Теплопроводность - процесс переноса энергии между контактирующими телами или двумя поверхностями одного и того же тела, возникающий из-за разности температур.
Закон теплопроводности (закон Фурье) - количество тепла dQ, перенесенное через площадку dS за время dt:
 ,
(2.87)
,
(2.87)
где æ - коэффициент теплопроводности;
dT/dz - скорость изменения (градиент) температуры в направлении z.
Коэффициент теплопроводности - физическая величина, которая показывает, какое количество тепла переносится через единичную площадку в единицу времени при градиенте температур, равном единице:
 ,
(2.88)
,
(2.88)
где c v – удельная теплоемкость при постоянном объеме.
Тепловой поток - физическая величина, которая показывает, какое количество тепла, переносится в единицу времени через площадь dS при градиенте температуры dT/dz:

 .
(2.89)
.
(2.89)
Связь между коэффициентами теплопроводности, диффузии и вязкости:
 ;
= D;
;
= D;
 .
(2.90)
.
(2.90)
 Молекулярная физика и термодинамика – это по существу две разные по своим подходам, но тесно связанные науки, занимающиеся одним и тем же – изучением макроскопических свойств физических систем, но совершенно разными методами
Молекулярная физика и термодинамика – это по существу две разные по своим подходам, но тесно связанные науки, занимающиеся одним и тем же – изучением макроскопических свойств физических систем, но совершенно разными методами
 Молекулярная физика В основе молекулярной физики или молекулярнокинетической теории лежат определенные представления о строении вещества. – Для установления законов поведения макроскопических систем, состоящих из огромного числа частиц, в молекулярной физике используются различные модели вещества, например, модели идеального газа. Молекулярная физика является статистической теорией, физика т. е. теорией, которая рассматривает поведение систем, состоящих из огромного числа частиц (атомов, молекул), на основе вероятностных моделей. Она стремится на основе статистического подхода установить связь между связь экспериментально измеренными макроскопическими величинами (давление, объем, температура и т. д.) и величинами микроскопическими характеристиками частиц, входящих микроскопическими характеристиками в состав системы (масса, импульс, энергия и т. д.).
Молекулярная физика В основе молекулярной физики или молекулярнокинетической теории лежат определенные представления о строении вещества. – Для установления законов поведения макроскопических систем, состоящих из огромного числа частиц, в молекулярной физике используются различные модели вещества, например, модели идеального газа. Молекулярная физика является статистической теорией, физика т. е. теорией, которая рассматривает поведение систем, состоящих из огромного числа частиц (атомов, молекул), на основе вероятностных моделей. Она стремится на основе статистического подхода установить связь между связь экспериментально измеренными макроскопическими величинами (давление, объем, температура и т. д.) и величинами микроскопическими характеристиками частиц, входящих микроскопическими характеристиками в состав системы (масса, импульс, энергия и т. д.).
 Термодинамика В отличие от молекулярно-кинетической теории, термодинамика при изучении свойств термодинамика макроскопических систем не опирается ни на какие представления о молекулярной структуре вещества. Термодинамика является наукой феноменологической. – Она делает выводы о свойствах вещества на основе законов, установленных на опыте, таких, как закон сохранения энергии. Термодинамика оперирует только с макроскопическими величинами (давление, температура, объем и т. п.), которые вводятся на основе физического эксперимента.
Термодинамика В отличие от молекулярно-кинетической теории, термодинамика при изучении свойств термодинамика макроскопических систем не опирается ни на какие представления о молекулярной структуре вещества. Термодинамика является наукой феноменологической. – Она делает выводы о свойствах вещества на основе законов, установленных на опыте, таких, как закон сохранения энергии. Термодинамика оперирует только с макроскопическими величинами (давление, температура, объем и т. п.), которые вводятся на основе физического эксперимента.
 Оба подхода – термодинамический и статистический – не противоречат, а дополняют друга. Только совместное использование термодинамики и молекулярнокинетической теории может дать наиболее полное представление о свойствах систем, состоящих из большого числа частиц
Оба подхода – термодинамический и статистический – не противоречат, а дополняют друга. Только совместное использование термодинамики и молекулярнокинетической теории может дать наиболее полное представление о свойствах систем, состоящих из большого числа частиц
 Молекулярная физика Молекулярно-кинетическая теория –– учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химических веществ.
Молекулярная физика Молекулярно-кинетическая теория –– учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химических веществ.
 Молекулярно-кинетическая теория Основные положения МКТ 1. Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»). Молекулы химического вещества могут быть простыми и сложными, т. е. состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы. 2. Атомы и молекулы находятся в непрерывном хаотическом движении, которое называют тепловым движением 3. Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
Молекулярно-кинетическая теория Основные положения МКТ 1. Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»). Молекулы химического вещества могут быть простыми и сложными, т. е. состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы. 2. Атомы и молекулы находятся в непрерывном хаотическом движении, которое называют тепловым движением 3. Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
 Молекулярно-кинетическая теория Наиболее ярким экспериментальным подтверждением представлений молекулярно-кинетической теории о беспорядочном движении атомов и молекул является броуновское движение. Броуновское движение –– это тепловое движение мельчайших микроскопических частиц, взвешенных в жидкости или газе. Оно было открыто английским ботаником Р. Броуном в 1827 г. Броуновские частицы движутся под влиянием беспорядочных ударов молекул. Из-за хаотического теплового движения молекул эти удары никогда не уравновешивают друга. В результате скорость броуновской частицы беспорядочно меняется по модулю и направлению, а ее траектория представляет собой сложную зигзагообразную кривую (рис.). Теория броуновского движения была создана А. Эйнштейном в 1905 г. Экспериментально теория Эйнштейна была подтверждена в опытах французского физика Ж. Перрена, проведенных в 1908– 1911 гг.
Молекулярно-кинетическая теория Наиболее ярким экспериментальным подтверждением представлений молекулярно-кинетической теории о беспорядочном движении атомов и молекул является броуновское движение. Броуновское движение –– это тепловое движение мельчайших микроскопических частиц, взвешенных в жидкости или газе. Оно было открыто английским ботаником Р. Броуном в 1827 г. Броуновские частицы движутся под влиянием беспорядочных ударов молекул. Из-за хаотического теплового движения молекул эти удары никогда не уравновешивают друга. В результате скорость броуновской частицы беспорядочно меняется по модулю и направлению, а ее траектория представляет собой сложную зигзагообразную кривую (рис.). Теория броуновского движения была создана А. Эйнштейном в 1905 г. Экспериментально теория Эйнштейна была подтверждена в опытах французского физика Ж. Перрена, проведенных в 1908– 1911 гг.
 Молекулярно-кинетическая теория Постоянное хаотичное движение молекул вещества проявляется также в другом легко наблюдаемом явлении – диффузии. Диффузией называется явление проникновения двух или нескольких соприкасающихся веществ друга. – Наиболее быстро процесс протекает в газе, если он газе неоднороден по составу. Диффузия приводит к образованию однородной смеси независимо от плотности компонентов. Так, если в двух частях сосуда, разделенных перегородкой, находятся кислород O 2 и водород H 2, то после удаления перегородки начинается процесс взаимопроникновения газов друга, приводящий к образованию взрывоопасной смеси – гремучего газа. Этот процесс идет и в том случае, когда легкий газ (водород) находится в верхней половине сосуда, а более тяжелый (кислород) – в нижней.
Молекулярно-кинетическая теория Постоянное хаотичное движение молекул вещества проявляется также в другом легко наблюдаемом явлении – диффузии. Диффузией называется явление проникновения двух или нескольких соприкасающихся веществ друга. – Наиболее быстро процесс протекает в газе, если он газе неоднороден по составу. Диффузия приводит к образованию однородной смеси независимо от плотности компонентов. Так, если в двух частях сосуда, разделенных перегородкой, находятся кислород O 2 и водород H 2, то после удаления перегородки начинается процесс взаимопроникновения газов друга, приводящий к образованию взрывоопасной смеси – гремучего газа. Этот процесс идет и в том случае, когда легкий газ (водород) находится в верхней половине сосуда, а более тяжелый (кислород) – в нижней.
 Молекулярно-кинетическая теория – Значительно медленнее протекают подобные процессы в жидкостях. Взаимопроникновение двух жидкостях разнородных жидкостей друг в друга, растворение твердых веществ в жидкостях (например, сахара в воде) и образование однородных растворов – примеры диффузионных процессов в жидкостях. В реальных условиях диффузия в жидкостях и газах маскируется более быстрыми процессами перемешивания, например, из-за возникновения конвекционных потоков.
Молекулярно-кинетическая теория – Значительно медленнее протекают подобные процессы в жидкостях. Взаимопроникновение двух жидкостях разнородных жидкостей друг в друга, растворение твердых веществ в жидкостях (например, сахара в воде) и образование однородных растворов – примеры диффузионных процессов в жидкостях. В реальных условиях диффузия в жидкостях и газах маскируется более быстрыми процессами перемешивания, например, из-за возникновения конвекционных потоков.
 Молекулярно-кинетическая теория – Наиболее медленно процесс диффузии протекает в твердых телах. Однако, опыты показывают, что при твердых телах контакте хорошо очищенных поверхностей двух металлов через длительное время в каждом из них обнаруживается атомы другого металла. Диффузия и броуновское движение – Диффузия и броуновское движение родственные явления. Взаимопроникновение соприкасающихся веществ друга и беспорядочное движение мельчайших частиц, взвешенных в жидкости или газе, происходят вследствие хаотичного теплового движения молекул.
Молекулярно-кинетическая теория – Наиболее медленно процесс диффузии протекает в твердых телах. Однако, опыты показывают, что при твердых телах контакте хорошо очищенных поверхностей двух металлов через длительное время в каждом из них обнаруживается атомы другого металла. Диффузия и броуновское движение – Диффузия и броуновское движение родственные явления. Взаимопроникновение соприкасающихся веществ друга и беспорядочное движение мельчайших частиц, взвешенных в жидкости или газе, происходят вследствие хаотичного теплового движения молекул.
 Молекулярно-кинетическая теория Силы, действующие между двумя молекулами, Силы, действующие между двумя молекулами зависят от расстояния между ними. Молекулы представляют собой сложные пространственные структуры, содержащие как положительные, так и отрицательные заряды. Если расстояние между молекулами достаточно велико, то преобладают силы межмолекулярного притяжения. На малых расстояниях преобладают силы отталкивания.
Молекулярно-кинетическая теория Силы, действующие между двумя молекулами, Силы, действующие между двумя молекулами зависят от расстояния между ними. Молекулы представляют собой сложные пространственные структуры, содержащие как положительные, так и отрицательные заряды. Если расстояние между молекулами достаточно велико, то преобладают силы межмолекулярного притяжения. На малых расстояниях преобладают силы отталкивания.
 Молекулярно-кинетическая теория При некотором расстоянии r = r 0 сила взаимодействия обращается в нуль. Это расстояние условно можно принять за диаметр молекулы. Потенциальная энергия взаимодействия при r = r 0 минимальна. Чтобы удалить друг от друга две молекулы, находящиеся на расстоянии r 0, нужно сообщить им дополнительную энергию E 0. Величина E 0 называется глубиной потенциальной ямы или энергией связи. Молекулы имеют чрезвычайно малые размеры. Простые одноатомные молекулы имеют размер порядка 10– 10 м. Сложные многоатомные молекулы могут иметь размеры в сотни и тысячи раз больше.
Молекулярно-кинетическая теория При некотором расстоянии r = r 0 сила взаимодействия обращается в нуль. Это расстояние условно можно принять за диаметр молекулы. Потенциальная энергия взаимодействия при r = r 0 минимальна. Чтобы удалить друг от друга две молекулы, находящиеся на расстоянии r 0, нужно сообщить им дополнительную энергию E 0. Величина E 0 называется глубиной потенциальной ямы или энергией связи. Молекулы имеют чрезвычайно малые размеры. Простые одноатомные молекулы имеют размер порядка 10– 10 м. Сложные многоатомные молекулы могут иметь размеры в сотни и тысячи раз больше.
 Молекулярно-кинетическая теория Кинетическая энергия теплового движения растет с возрастанием температуры При низких температурах средняя кинетическая энергия молекулы может оказаться меньше глубины потенциальной ямы E 0. В этом случае молекулы конденсируются в жидкое или твердое вещество; при этом среднее расстояние между молекулами будет приблизительно равно r 0. При повышении температуры средняя кинетическая энергия молекулы становится больше E 0, молекулы разлетаются, и образуется газообразное вещество
Молекулярно-кинетическая теория Кинетическая энергия теплового движения растет с возрастанием температуры При низких температурах средняя кинетическая энергия молекулы может оказаться меньше глубины потенциальной ямы E 0. В этом случае молекулы конденсируются в жидкое или твердое вещество; при этом среднее расстояние между молекулами будет приблизительно равно r 0. При повышении температуры средняя кинетическая энергия молекулы становится больше E 0, молекулы разлетаются, и образуется газообразное вещество
 Молекулярно-кинетическая теория Агрегатные состояния вещества В твердых телах молекулы совершают твердых телах беспорядочные колебания около фиксированных центров (положений равновесия). Эти центры могут быть расположены в пространстве нерегулярным образом (аморфные тела) или образовывать упорядоченные объемные структуры (кристаллические тела). Поэтому твердые тела сохраняют и форму, и объем
Молекулярно-кинетическая теория Агрегатные состояния вещества В твердых телах молекулы совершают твердых телах беспорядочные колебания около фиксированных центров (положений равновесия). Эти центры могут быть расположены в пространстве нерегулярным образом (аморфные тела) или образовывать упорядоченные объемные структуры (кристаллические тела). Поэтому твердые тела сохраняют и форму, и объем
 Молекулярно-кинетическая теория Агрегатные состояния вещества В жидкостях молекулы имеют значительно большую свободу для теплового движения. Они не привязаны к определенным центрам и могут перемещаться по всему объему. Этим объясняется текучесть жидкостей. Близко расположенные молекулы жидкости также могут образовывать упорядоченные структуры, содержащие несколько молекул. Это явление называется ближним порядком в отличие от дальнего порядка, характерного для кристаллических тел. Поэтому жидкости не сохраняют форму, но сохраняют объем
Молекулярно-кинетическая теория Агрегатные состояния вещества В жидкостях молекулы имеют значительно большую свободу для теплового движения. Они не привязаны к определенным центрам и могут перемещаться по всему объему. Этим объясняется текучесть жидкостей. Близко расположенные молекулы жидкости также могут образовывать упорядоченные структуры, содержащие несколько молекул. Это явление называется ближним порядком в отличие от дальнего порядка, характерного для кристаллических тел. Поэтому жидкости не сохраняют форму, но сохраняют объем
 Молекулярно-кинетическая теория Агрегатные состояния вещества В газах расстояния между молекулами обычно значительно больше их размеров. Силы взаимодействия между молекулами на таких больших расстояниях малы, и каждая молекула движется вдоль прямой линии до очередного столкновения с другой молекулой или со стенкой сосуда. – Среднее расстояние между молекулами воздуха при нормальных условиях порядка 10– 8 м, т. е. в десятки раз превышает размер молекул. Слабое взаимодействие между молекулами объясняет способность газов расширяться и заполнять весь объем сосуда. В пределе, когда взаимодействие стремится к нулю, мы приходим к представлению об идеальном газе. Поэтому газы не сохраняют ни форму, ни объем
Молекулярно-кинетическая теория Агрегатные состояния вещества В газах расстояния между молекулами обычно значительно больше их размеров. Силы взаимодействия между молекулами на таких больших расстояниях малы, и каждая молекула движется вдоль прямой линии до очередного столкновения с другой молекулой или со стенкой сосуда. – Среднее расстояние между молекулами воздуха при нормальных условиях порядка 10– 8 м, т. е. в десятки раз превышает размер молекул. Слабое взаимодействие между молекулами объясняет способность газов расширяться и заполнять весь объем сосуда. В пределе, когда взаимодействие стремится к нулю, мы приходим к представлению об идеальном газе. Поэтому газы не сохраняют ни форму, ни объем
 Молекулярно-кинетическая теория Количество вещества В молекулярно-кинетической теории количество вещества принято считать пропорциональным числу вещества частиц. Единица количества вещества называется молем (моль). Моль – это количество вещества, содержащее столько же частиц (молекул), сколько содержится атомов 0, 012 кг углерода 12 C. (Молекула углерода состоит из одного атома) Таким образом, в одном моле любого вещества содержится одно и то же число частиц (молекул). Это число называется постоянной Авогадро NА: NА = 6, 02· 1023 моль– 1. Постоянная Авогадро – одна из важнейших постоянных в молекулярно-кинетической теории.
Молекулярно-кинетическая теория Количество вещества В молекулярно-кинетической теории количество вещества принято считать пропорциональным числу вещества частиц. Единица количества вещества называется молем (моль). Моль – это количество вещества, содержащее столько же частиц (молекул), сколько содержится атомов 0, 012 кг углерода 12 C. (Молекула углерода состоит из одного атома) Таким образом, в одном моле любого вещества содержится одно и то же число частиц (молекул). Это число называется постоянной Авогадро NА: NА = 6, 02· 1023 моль– 1. Постоянная Авогадро – одна из важнейших постоянных в молекулярно-кинетической теории.
 Молекулярно-кинетическая теория Количество вещества ν определяется как отношение числа N частиц (молекул) вещества к постоянной Авогадро NА: Массу одного моля вещества принято называть молярной массой M Молярная масса равна произведению массы m 0 одной молекулы данного вещества на постоянную Авогадро: M = NА · m 0 Молярная масса выражается в килограммах на моль (кг/моль). Для веществ, молекулы которых состоят из одного атома, часто используется термин атомная масса. За единицу массы атомов и молекул принимается 1/12 массы атома изотопа углерода 12 C (с массовым числом 12). Эта единица называется атомной единицей массы(а. е. м.): 1 а. е. м. = 1, 66· 10– 27 кг. Эта величина почти совпадает с массой протона или нейтрона. Отношение массы атома или молекулы данного вещества к 1/12 массы атома углерода 12 C называется относительной массой.
Молекулярно-кинетическая теория Количество вещества ν определяется как отношение числа N частиц (молекул) вещества к постоянной Авогадро NА: Массу одного моля вещества принято называть молярной массой M Молярная масса равна произведению массы m 0 одной молекулы данного вещества на постоянную Авогадро: M = NА · m 0 Молярная масса выражается в килограммах на моль (кг/моль). Для веществ, молекулы которых состоят из одного атома, часто используется термин атомная масса. За единицу массы атомов и молекул принимается 1/12 массы атома изотопа углерода 12 C (с массовым числом 12). Эта единица называется атомной единицей массы(а. е. м.): 1 а. е. м. = 1, 66· 10– 27 кг. Эта величина почти совпадает с массой протона или нейтрона. Отношение массы атома или молекулы данного вещества к 1/12 массы атома углерода 12 C называется относительной массой.
 Молекулярно-кинетическая теория Простейшей моделью, рассматриваемой молекулярнокинетической теорией, является модель идеального газа: 1. В кинетической модели идеального газа молекулы 1. рассматриваются как идеально упругие шарики, взаимодействующие между собой и со стенками только во время упругих столкновений. 2. Суммарный объем всех молекул предполагается малым по 2. сравнению с объемом сосуда, в котором находится газ. Модель идеального газа достаточно хорошо описывает поведение реальных газов в широком диапазоне давлений и температур. Задача молекулярно-кинетической теории состоит в том, чтобы установить связь между микроскопическими (масса, микроскопическими скорость, кинетическая энергия молекул) и макроскопическими параметрами (давление, объем, макроскопическими параметрами температура).
Молекулярно-кинетическая теория Простейшей моделью, рассматриваемой молекулярнокинетической теорией, является модель идеального газа: 1. В кинетической модели идеального газа молекулы 1. рассматриваются как идеально упругие шарики, взаимодействующие между собой и со стенками только во время упругих столкновений. 2. Суммарный объем всех молекул предполагается малым по 2. сравнению с объемом сосуда, в котором находится газ. Модель идеального газа достаточно хорошо описывает поведение реальных газов в широком диапазоне давлений и температур. Задача молекулярно-кинетической теории состоит в том, чтобы установить связь между микроскопическими (масса, микроскопическими скорость, кинетическая энергия молекул) и макроскопическими параметрами (давление, объем, макроскопическими параметрами температура).
 Молекулярно-кинетическая теория В результате каждого столкновения между молекулами и молекул со стенками скорости молекул могут изменяться по модулю и по направлению; на интервалах времени между последовательными столкновениями молекулы движутся равномерно и прямолинейно. В модели идеального газа предполагается, что все столкновения происходят по законам упругого удара, т. е. подчиняются законам механики Ньютона. Используя модель идеального газа, вычислим давление газа на стенку сосуда. В процессе взаимодействия молекулы со стенкой сосуда между ними возникают силы, подчиняющиеся третьему закону Ньютона. В результате проекция υx скорости молекулы, перпендикулярная стенке, изменяет свой знак на противоположный, а проекция υy скорости, параллельная стенке, остается неизменной (рис.).
Молекулярно-кинетическая теория В результате каждого столкновения между молекулами и молекул со стенками скорости молекул могут изменяться по модулю и по направлению; на интервалах времени между последовательными столкновениями молекулы движутся равномерно и прямолинейно. В модели идеального газа предполагается, что все столкновения происходят по законам упругого удара, т. е. подчиняются законам механики Ньютона. Используя модель идеального газа, вычислим давление газа на стенку сосуда. В процессе взаимодействия молекулы со стенкой сосуда между ними возникают силы, подчиняющиеся третьему закону Ньютона. В результате проекция υx скорости молекулы, перпендикулярная стенке, изменяет свой знак на противоположный, а проекция υy скорости, параллельная стенке, остается неизменной (рис.).
 Молекулярно-кинетическая теория Формула для среднего давления газа на стенку сосуда запишется в виде Это уравнение устанавливает связь между давлением p идеального газа, массой молекулы m 0, концентрацией молекул n, средним значением квадрата скорости и средней кинетической энергией поступательного движения молекул. Это основное уравнение молекулярно-кинетической теории газов Таким образом, давление газа равно двум третям средней кинетической энергии поступательного движения молекул, содержащихся в единице объема.
Молекулярно-кинетическая теория Формула для среднего давления газа на стенку сосуда запишется в виде Это уравнение устанавливает связь между давлением p идеального газа, массой молекулы m 0, концентрацией молекул n, средним значением квадрата скорости и средней кинетической энергией поступательного движения молекул. Это основное уравнение молекулярно-кинетической теории газов Таким образом, давление газа равно двум третям средней кинетической энергии поступательного движения молекул, содержащихся в единице объема.
 Молекулярно-кинетическая теория В основное уравнение МКТ газов входит произведение концентрации молекул n на среднюю кинетическую энергию поступательного движения. В этом случае давление пропорционально средней кинетической энергии. Возникают вопросы: каким образом можно на опыте изменять среднюю кинетическую энергию движения молекул в сосуде неизменного объема? Какую физическую величину нужно изменить, чтобы изменилась средняя кинетическая энергия? Опыт показывает, что такой величиной является температура.
Молекулярно-кинетическая теория В основное уравнение МКТ газов входит произведение концентрации молекул n на среднюю кинетическую энергию поступательного движения. В этом случае давление пропорционально средней кинетической энергии. Возникают вопросы: каким образом можно на опыте изменять среднюю кинетическую энергию движения молекул в сосуде неизменного объема? Какую физическую величину нужно изменить, чтобы изменилась средняя кинетическая энергия? Опыт показывает, что такой величиной является температура.
 Молекулярно-кинетическая теория Температура Понятие температуры тесно связано с понятием теплового равновесия. Тела, находящиеся в контакте друг с другом, могут обмениваться энергией. Энергия, передаваемая одним телом другому при тепловом контакте, называется количеством теплоты Q. Тепловое равновесие – это такое состояние системы тел, находящихся в тепловом контакте, при котором не происходит теплопередачи от одного тела к другому, и все макроскопические параметры тел остаются неизменными. Температура – это физический параметр, одинаковый для Температура всех тел, находящихся в тепловом равновесии. Возможность введения понятия температуры следует из опыта и носит название нулевого закона термодинамики.
Молекулярно-кинетическая теория Температура Понятие температуры тесно связано с понятием теплового равновесия. Тела, находящиеся в контакте друг с другом, могут обмениваться энергией. Энергия, передаваемая одним телом другому при тепловом контакте, называется количеством теплоты Q. Тепловое равновесие – это такое состояние системы тел, находящихся в тепловом контакте, при котором не происходит теплопередачи от одного тела к другому, и все макроскопические параметры тел остаются неизменными. Температура – это физический параметр, одинаковый для Температура всех тел, находящихся в тепловом равновесии. Возможность введения понятия температуры следует из опыта и носит название нулевого закона термодинамики.
 Молекулярно-кинетическая теория Температура Для измерения температуры используются физические приборы – термометры, в которых о величине температуры судят по изменению какоголибо физического параметра. Для создания термометра необходимо выбрать термометрическое вещество (например, ртуть, спирт) и термометрическую величину, характеризующую свойство вещества (например, длина ртутного или спиртового столбика). В различных конструкциях термометров используются разнообразные физические свойства вещества (например, изменение линейных размеров твердых тел или изменение электрического сопротивления проводников при нагревании). Термометры должны быть откалиброваны.
Молекулярно-кинетическая теория Температура Для измерения температуры используются физические приборы – термометры, в которых о величине температуры судят по изменению какоголибо физического параметра. Для создания термометра необходимо выбрать термометрическое вещество (например, ртуть, спирт) и термометрическую величину, характеризующую свойство вещества (например, длина ртутного или спиртового столбика). В различных конструкциях термометров используются разнообразные физические свойства вещества (например, изменение линейных размеров твердых тел или изменение электрического сопротивления проводников при нагревании). Термометры должны быть откалиброваны.
 Молекулярно-кинетическая теория Особое место в физике занимают газовые термометры (рис.), в которых термометрическим веществом является разреженный газ (гелий, воздух) в сосуде неизменного объема (V = const), а термометрической величиной – давление газа p. Опыт показывает, что давление газа (при V = const) растет с ростом температуры, измеренной по шкале Цельсия.
Молекулярно-кинетическая теория Особое место в физике занимают газовые термометры (рис.), в которых термометрическим веществом является разреженный газ (гелий, воздух) в сосуде неизменного объема (V = const), а термометрической величиной – давление газа p. Опыт показывает, что давление газа (при V = const) растет с ростом температуры, измеренной по шкале Цельсия.
 Молекулярно-кинетическая теория Чтобы проградуировать газовый термометр постоянного объема, можно измерить давление при двух значениях температуры (например, 0 °C и 100 °C), нанести точки p 0 и p 100 на график, а затем провести между ними прямую линию (рис.). Используя полученный таким образом калибровочный график, можно определять температуры, соответствующие другим значениям давления. Экстраполируя график в область низких давлений, можно Экстраполируя график в область низких давлений определить некоторую «гипотетическую» температуру, при которой давление газа стало бы равным нулю. Опыт показывает, что эта температура равна – 273, 15 °С и не зависит от свойств газа. На опыте получить путем охлаждения газ в состоянии с нулевым давлением невозможно, так как при очень низких температурах все газы переходят в жидкое или твердое состояние.
Молекулярно-кинетическая теория Чтобы проградуировать газовый термометр постоянного объема, можно измерить давление при двух значениях температуры (например, 0 °C и 100 °C), нанести точки p 0 и p 100 на график, а затем провести между ними прямую линию (рис.). Используя полученный таким образом калибровочный график, можно определять температуры, соответствующие другим значениям давления. Экстраполируя график в область низких давлений, можно Экстраполируя график в область низких давлений определить некоторую «гипотетическую» температуру, при которой давление газа стало бы равным нулю. Опыт показывает, что эта температура равна – 273, 15 °С и не зависит от свойств газа. На опыте получить путем охлаждения газ в состоянии с нулевым давлением невозможно, так как при очень низких температурах все газы переходят в жидкое или твердое состояние.
 Молекулярно-кинетическая теория Английский физик У. Кельвин (Томсон) в 1848 г. предложил использовать точку нулевого давления газа для построения новой температурной шкалы (шкала Кельвина). В этой шкале единица измерения температуры такая же, как и в шкале Цельсия, но нулевая точка сдвинута: TК = TС + 273, 15. В системе СИ принято единицу измерения температуры по шкале Кельвина называть кельвином и обозначать буквой K. Например, комнатная температура TС = 20 °С по шкале Кельвина равна TК = 293, 15 К.
Молекулярно-кинетическая теория Английский физик У. Кельвин (Томсон) в 1848 г. предложил использовать точку нулевого давления газа для построения новой температурной шкалы (шкала Кельвина). В этой шкале единица измерения температуры такая же, как и в шкале Цельсия, но нулевая точка сдвинута: TК = TС + 273, 15. В системе СИ принято единицу измерения температуры по шкале Кельвина называть кельвином и обозначать буквой K. Например, комнатная температура TС = 20 °С по шкале Кельвина равна TК = 293, 15 К.
 Молекулярно-кинетическая теория Температурная шкала Кельвина называется абсолютной шкалой температур. Она оказывается наиболее шкалой температур удобной при построении физических теорий. Нет необходимости привязывать шкалу Кельвина к двум фиксированным точкам – точке плавления льда и точке кипения воды при нормальном атмосферном давлении, как это принято в шкале Цельсия. Кроме точки нулевого давления газа, которая называется абсолютным нулем температуры, абсолютным нулем температуры достаточно принять еще одну фиксированную опорную точку. В шкале Кельвина в качестве такой точки используется температура тройной точки воды (0, 01 °С), в которой в тепловом равновесии находятся все три фазы – лед, вода и пар. По шкале Кельвина температура тройной точки принимается равной 273, 16 К.
Молекулярно-кинетическая теория Температурная шкала Кельвина называется абсолютной шкалой температур. Она оказывается наиболее шкалой температур удобной при построении физических теорий. Нет необходимости привязывать шкалу Кельвина к двум фиксированным точкам – точке плавления льда и точке кипения воды при нормальном атмосферном давлении, как это принято в шкале Цельсия. Кроме точки нулевого давления газа, которая называется абсолютным нулем температуры, абсолютным нулем температуры достаточно принять еще одну фиксированную опорную точку. В шкале Кельвина в качестве такой точки используется температура тройной точки воды (0, 01 °С), в которой в тепловом равновесии находятся все три фазы – лед, вода и пар. По шкале Кельвина температура тройной точки принимается равной 273, 16 К.
 Молекулярно-кинетическая теория Таким образом, давление разреженного газа в сосуде постоянного объема V изменяется прямо пропорционально его абсолютной температуре: p ~ T. T С другой стороны, опыт показывает, что при неизменных объеме V и температуре T давление газа изменяется прямо пропорционально отношению количества вещества ν в данном сосуде к объему V сосуда где N – число молекул в сосуде, NА – постоянная Авогадро, n = N / V – концентрация молекул (т. е. число молекул в единице объема сосуда).
Молекулярно-кинетическая теория Таким образом, давление разреженного газа в сосуде постоянного объема V изменяется прямо пропорционально его абсолютной температуре: p ~ T. T С другой стороны, опыт показывает, что при неизменных объеме V и температуре T давление газа изменяется прямо пропорционально отношению количества вещества ν в данном сосуде к объему V сосуда где N – число молекул в сосуде, NА – постоянная Авогадро, n = N / V – концентрация молекул (т. е. число молекул в единице объема сосуда).
 Молекулярно-кинетическая теория Объединяя эти соотношения пропорциональности, можно записать: p = nk. T, где k – некоторая универсальная для всех газов постоянная величина. Ее называют постоянной Больцмана, в честь австрийского физика Л. Больцмана, одного из создателей МКТ. Постоянная Больцмана – одна из фундаментальных физических констант. Ее численное значение в СИ: k = 1, 38· 10– 23 Дж/К.
Молекулярно-кинетическая теория Объединяя эти соотношения пропорциональности, можно записать: p = nk. T, где k – некоторая универсальная для всех газов постоянная величина. Ее называют постоянной Больцмана, в честь австрийского физика Л. Больцмана, одного из создателей МКТ. Постоянная Больцмана – одна из фундаментальных физических констант. Ее численное значение в СИ: k = 1, 38· 10– 23 Дж/К.
 Молекулярно-кинетическая теория Сравнивая соотношения p = nk. T с основным уравнением МКТ газов, можно получить: Средняя кинетическая энергия хаотического движения молекул газа прямо пропорциональна абсолютной температуре. Таким образом, температура есть мера средней кинетической энергии поступательного движения молекул Следует обратить внимание на то, что средняя кинетическая энергия поступательного движения молекулы не зависит от ее массы. Броуновская частица, взвешенная в жидкости или газе, обладает такой же средней кинетической энергией, как и отдельная молекула, масса которой на много порядков меньше массы броуновской частицы.
Молекулярно-кинетическая теория Сравнивая соотношения p = nk. T с основным уравнением МКТ газов, можно получить: Средняя кинетическая энергия хаотического движения молекул газа прямо пропорциональна абсолютной температуре. Таким образом, температура есть мера средней кинетической энергии поступательного движения молекул Следует обратить внимание на то, что средняя кинетическая энергия поступательного движения молекулы не зависит от ее массы. Броуновская частица, взвешенная в жидкости или газе, обладает такой же средней кинетической энергией, как и отдельная молекула, масса которой на много порядков меньше массы броуновской частицы.
 Молекулярно-кинетическая теория Этот вывод распространяется и на случай, когда в сосуде находится смесь химически невзаимодействующих газов, молекулы которых имеют разные массы. В состоянии равновесия молекулы разных газов будут иметь одинаковые средние кинетические энергии теплового движения, определяемые только температурой смеси. Давление смеси газов на стенки сосуда будет складываться из парциальных давлений каждого газа: p = p 1 + p 2 + p 3 + … = (n 1 + n 2 + n 3 + …)k. T В этом соотношении n 1, n 2, n 3, … – концентрации молекул различных газов в смеси. Это соотношение выражает на языке молекулярнокинетической теории экспериментально установленный в начале XIX столетия закон Дальтона: давление в смеси закон Дальтона химически невзаимодействующих газов равно сумме их парциальных давлений.
Молекулярно-кинетическая теория Этот вывод распространяется и на случай, когда в сосуде находится смесь химически невзаимодействующих газов, молекулы которых имеют разные массы. В состоянии равновесия молекулы разных газов будут иметь одинаковые средние кинетические энергии теплового движения, определяемые только температурой смеси. Давление смеси газов на стенки сосуда будет складываться из парциальных давлений каждого газа: p = p 1 + p 2 + p 3 + … = (n 1 + n 2 + n 3 + …)k. T В этом соотношении n 1, n 2, n 3, … – концентрации молекул различных газов в смеси. Это соотношение выражает на языке молекулярнокинетической теории экспериментально установленный в начале XIX столетия закон Дальтона: давление в смеси закон Дальтона химически невзаимодействующих газов равно сумме их парциальных давлений.
 Молекулярно-кинетическая теория Уравнение состояния идеального газа Соотношение p = nk. T может быть записано в другой форме, устанавливающей связь между макроскопическими параметрами газа – объемом V, давлением p, температурой T и количеством вещества ν = m / M. M –– Это соотношение называется уравнением состояния идеального газа или уравнением состояния идеального газа Клапейрона–Менделеева – Произведение постоянной Авогадро NА на постоянную Больцмана k называется универсальной газовой постоянной и обозначается буквой R. Ее численное значение в СИ есть: R = k ∙NА = 8, 31 Дж/моль·К.
Молекулярно-кинетическая теория Уравнение состояния идеального газа Соотношение p = nk. T может быть записано в другой форме, устанавливающей связь между макроскопическими параметрами газа – объемом V, давлением p, температурой T и количеством вещества ν = m / M. M –– Это соотношение называется уравнением состояния идеального газа или уравнением состояния идеального газа Клапейрона–Менделеева – Произведение постоянной Авогадро NА на постоянную Больцмана k называется универсальной газовой постоянной и обозначается буквой R. Ее численное значение в СИ есть: R = k ∙NА = 8, 31 Дж/моль·К.
 Молекулярно-кинетическая теория Уравнение состояния идеального газа – Если температура газа равна Tн = 273, 15 К (0 °С), а давление pн = 1 атм = 1, 013· 105 Па, то говорят, что газ находится при нормальных условиях. Как следует из уравнения состояния идеального газа, один моль любого газа при нормальных условиях занимает один и тот же объем V 0 = 0, 0224 м 3/моль = 22, 4 дм 3/моль. Это утверждение называется законом Авогадро.
Молекулярно-кинетическая теория Уравнение состояния идеального газа – Если температура газа равна Tн = 273, 15 К (0 °С), а давление pн = 1 атм = 1, 013· 105 Па, то говорят, что газ находится при нормальных условиях. Как следует из уравнения состояния идеального газа, один моль любого газа при нормальных условиях занимает один и тот же объем V 0 = 0, 0224 м 3/моль = 22, 4 дм 3/моль. Это утверждение называется законом Авогадро.
 Молекулярно-кинетическая теория Изопроцессы Газ может участвовать в различных тепловых процессах, при которых могут изменяться все параметры, описывающие его состояние (p, V и T). Если процесс протекает достаточно медленно, то в любой момент система близка к своему равновесному состоянию. Такие процессы называются квазистатическими. В привычном квазистатическими для нас масштабе времени эти процессы могут протекать и не очень медленно. Например, разрежения и сжатия газа в звуковой волне, происходящие сотни раз в секунду, можно рассматривать как квазистатический процесс. Квазистатические процессы могут быть изображены на диаграмме состояний(например, в координатах p, V) в виде некоторой траектории, каждая точка которой представляет равновесное состояние. Интерес представляют процессы, в которых один из параметров (p, V или T) остается неизменным. Такие процессы называются изопроцессами
Молекулярно-кинетическая теория Изопроцессы Газ может участвовать в различных тепловых процессах, при которых могут изменяться все параметры, описывающие его состояние (p, V и T). Если процесс протекает достаточно медленно, то в любой момент система близка к своему равновесному состоянию. Такие процессы называются квазистатическими. В привычном квазистатическими для нас масштабе времени эти процессы могут протекать и не очень медленно. Например, разрежения и сжатия газа в звуковой волне, происходящие сотни раз в секунду, можно рассматривать как квазистатический процесс. Квазистатические процессы могут быть изображены на диаграмме состояний(например, в координатах p, V) в виде некоторой траектории, каждая точка которой представляет равновесное состояние. Интерес представляют процессы, в которых один из параметров (p, V или T) остается неизменным. Такие процессы называются изопроцессами
 Изотермический процесс (T = const) Изотермическим процессом называют квазистатический процесс, протекающий при постоянной температуре T. Из уравнения состояния идеального газа следует, что при постоянной температуре T и T неизменном количестве вещества ν в сосуде произведение давления p газа на его p объем V должно оставаться постоянным: p. V = const
Изотермический процесс (T = const) Изотермическим процессом называют квазистатический процесс, протекающий при постоянной температуре T. Из уравнения состояния идеального газа следует, что при постоянной температуре T и T неизменном количестве вещества ν в сосуде произведение давления p газа на его p объем V должно оставаться постоянным: p. V = const
 Изотермический процесс (T = const) На плоскости (p, V) изотермические процессы изображаются при различных значениях температуры T семейством гипербол p ~ 1 / V, которые называются изотермами. Уравнение изотермического процесса было получено из эксперимента английским физиком Р. Бойлем (1662 г.) и независимо французским физиком Э. Мариоттом (1676 г.) Поэтому уравнение называют законом Бойля–Мариотта. T 3 > T 2 > T 1
Изотермический процесс (T = const) На плоскости (p, V) изотермические процессы изображаются при различных значениях температуры T семейством гипербол p ~ 1 / V, которые называются изотермами. Уравнение изотермического процесса было получено из эксперимента английским физиком Р. Бойлем (1662 г.) и независимо французским физиком Э. Мариоттом (1676 г.) Поэтому уравнение называют законом Бойля–Мариотта. T 3 > T 2 > T 1
 Изохорный процесс (V = const) Изохорный процесс – это процесс квазистатического нагревания или охлаждения газа при постоянном объеме V и при условии, что количество вещества ν в сосуде остается неизменным. Как следует из уравнения состояния идеального газа, при этих условиях давление газа p изменяется прямо пропорционально его абсолютной температуре: p ~ T или = const
Изохорный процесс (V = const) Изохорный процесс – это процесс квазистатического нагревания или охлаждения газа при постоянном объеме V и при условии, что количество вещества ν в сосуде остается неизменным. Как следует из уравнения состояния идеального газа, при этих условиях давление газа p изменяется прямо пропорционально его абсолютной температуре: p ~ T или = const
 Изохорный процесс (V = const) На плоскости (p, T) изохорные процессы для заданного количества вещества ν при различных значениях объема V изображаются семейством прямых линий, которые называются изохорами. Большим значениям объема соответствуют изохоры с меньшим наклоном по отношению к оси температур (рис.). Экспериментально зависимость давления газа от температуры исследовал французский физик Ж. Шарль (1787 г.). Поэтому уравнение изохорного процесса называется законом Шарля. V 3 > V 2 > V 1
Изохорный процесс (V = const) На плоскости (p, T) изохорные процессы для заданного количества вещества ν при различных значениях объема V изображаются семейством прямых линий, которые называются изохорами. Большим значениям объема соответствуют изохоры с меньшим наклоном по отношению к оси температур (рис.). Экспериментально зависимость давления газа от температуры исследовал французский физик Ж. Шарль (1787 г.). Поэтому уравнение изохорного процесса называется законом Шарля. V 3 > V 2 > V 1
 Изобарный процесс (p = const) Изобарным процессом называют квазистатический процесс, протекающий при неизменным давлении p. Уравнение изобарного процесса для некоторого неизменного количества вещества ν имеет вид: где V 0 – объем газа при температуре 0 °С. Коэффициент α равен (1/273, 15) К– 1. Его α называют температурным коэффициентом объемного расширения газов.
Изобарный процесс (p = const) Изобарным процессом называют квазистатический процесс, протекающий при неизменным давлении p. Уравнение изобарного процесса для некоторого неизменного количества вещества ν имеет вид: где V 0 – объем газа при температуре 0 °С. Коэффициент α равен (1/273, 15) К– 1. Его α называют температурным коэффициентом объемного расширения газов.
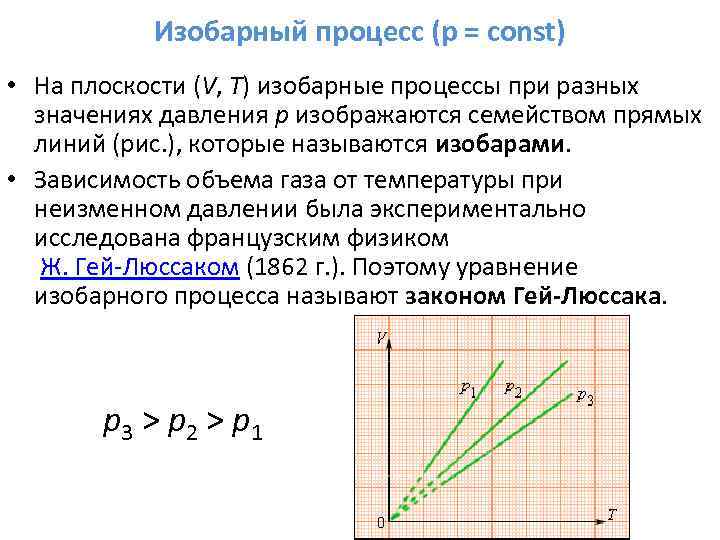 Изобарный процесс (p = const) На плоскости (V, T) изобарные процессы при разных значениях давления p изображаются семейством прямых линий (рис.), которые называются изобарами. Зависимость объема газа от температуры при неизменном давлении была экспериментально исследована французским физиком Ж. Гей-Люссаком (1862 г.). Поэтому уравнение изобарного процесса называют законом Гей-Люссака. p 3 > p 2 > p 1
Изобарный процесс (p = const) На плоскости (V, T) изобарные процессы при разных значениях давления p изображаются семейством прямых линий (рис.), которые называются изобарами. Зависимость объема газа от температуры при неизменном давлении была экспериментально исследована французским физиком Ж. Гей-Люссаком (1862 г.). Поэтому уравнение изобарного процесса называют законом Гей-Люссака. p 3 > p 2 > p 1
 Изопроцессы Экспериментально установленные законы Бойля –Мариотта, Шарля и Гей-Люссака находят –Мариотта, Шарля и Гей-Люссака объяснение в молекулярно-кинетической теории газов. Они являются следствием уравнения состояния идеального газа.
Изопроцессы Экспериментально установленные законы Бойля –Мариотта, Шарля и Гей-Люссака находят –Мариотта, Шарля и Гей-Люссака объяснение в молекулярно-кинетической теории газов. Они являются следствием уравнения состояния идеального газа.
 Термодинамика Термодинамика – это наука о тепловых явлениях. В противоположность молекулярно-кинетической теории, которая делает выводы на основе представлений о молекулярном строении вещества, термодинамика исходит из наиболее общих закономерностей тепловых процессов и свойств макроскопических систем. Выводы термодинамики опираются на совокупность опытных фактов и не зависят от наших знаний о внутреннем устройстве вещества, хотя в целом ряде случаев термодинамика использует молекулярнокинетические модели для иллюстрации своих выводов.
Термодинамика Термодинамика – это наука о тепловых явлениях. В противоположность молекулярно-кинетической теории, которая делает выводы на основе представлений о молекулярном строении вещества, термодинамика исходит из наиболее общих закономерностей тепловых процессов и свойств макроскопических систем. Выводы термодинамики опираются на совокупность опытных фактов и не зависят от наших знаний о внутреннем устройстве вещества, хотя в целом ряде случаев термодинамика использует молекулярнокинетические модели для иллюстрации своих выводов.
 Термодинамика Термодинамика рассматривает изолированные системы тел, находящиеся в состоянии термодинамического равновесия. Это означает, что в таких системах прекратились все наблюдаемые макроскопические процессы.
Термодинамика Термодинамика рассматривает изолированные системы тел, находящиеся в состоянии термодинамического равновесия. Это означает, что в таких системах прекратились все наблюдаемые макроскопические процессы.
 Термодинамика Если термодинамическая система была подвержена внешнему воздействию, то в конечном итоге она перейдет в другое равновесное состояние. Такой переход называется термодинамическим процессом. Если процесс протекает достаточно медленно (в пределе бесконечно медленно), то система в каждый момент времени оказывается близкой к равновесному состоянию. Процессы, состоящие из последовательности равновесных состояний, называются квазистатическими.
Термодинамика Если термодинамическая система была подвержена внешнему воздействию, то в конечном итоге она перейдет в другое равновесное состояние. Такой переход называется термодинамическим процессом. Если процесс протекает достаточно медленно (в пределе бесконечно медленно), то система в каждый момент времени оказывается близкой к равновесному состоянию. Процессы, состоящие из последовательности равновесных состояний, называются квазистатическими.
 Термодинамика. Внутренняя энергия Одним из важнейших понятий термодинамики является внутренняя энергия тела. Все макроскопические тела обладают энергией, заключенной внутри самих тел. С точки зрения МКТ внутренняя энергия вещества складывается из кинетической энергии всех атомов и молекул и потенциальной энергии их взаимодействия друг с другом. В частности, внутренняя энергия идеального газа равна сумме кинетических энергий всех частиц газа, находящихся в непрерывном и беспорядочном тепловом движении. Отсюда вытекает закон Джоуля, подтверждаемый многочисленными экспериментами: Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема
Термодинамика. Внутренняя энергия Одним из важнейших понятий термодинамики является внутренняя энергия тела. Все макроскопические тела обладают энергией, заключенной внутри самих тел. С точки зрения МКТ внутренняя энергия вещества складывается из кинетической энергии всех атомов и молекул и потенциальной энергии их взаимодействия друг с другом. В частности, внутренняя энергия идеального газа равна сумме кинетических энергий всех частиц газа, находящихся в непрерывном и беспорядочном тепловом движении. Отсюда вытекает закон Джоуля, подтверждаемый многочисленными экспериментами: Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема
 Термодинамика. Внутренняя энергия МКТ приводит к следующему выражению для внутренней энергии одного моля идеального одноатомного газа (гелий, неон и др.), молекулы которого совершают только поступательное движение: Поскольку потенциальная энергия взаимодействия молекул зависит от расстояния между ними, в общем случае внутренняя энергия U тела зависит наряду с температурой T также и от объема V: T U = U (T, V) Таким образом, внутренняя энергия U тела однозначно определяется макроскопическими параметрами, характеризующими состояние тела. Она не зависит от того, каким путем было реализовано данное состояние. Принято говорить, что внутренняя энергия является функцией состояния.
Термодинамика. Внутренняя энергия МКТ приводит к следующему выражению для внутренней энергии одного моля идеального одноатомного газа (гелий, неон и др.), молекулы которого совершают только поступательное движение: Поскольку потенциальная энергия взаимодействия молекул зависит от расстояния между ними, в общем случае внутренняя энергия U тела зависит наряду с температурой T также и от объема V: T U = U (T, V) Таким образом, внутренняя энергия U тела однозначно определяется макроскопическими параметрами, характеризующими состояние тела. Она не зависит от того, каким путем было реализовано данное состояние. Принято говорить, что внутренняя энергия является функцией состояния.
 Термодинамика. Способы изменения внутренней энергии Внутренняя энергия тела может изменяться, если действующие на него внешние силы совершают работу (положительную или отрицательную). работу Например, если газ подвергается сжатию в цилиндре под поршнем, то внешние силы совершают над газом некоторую положительную работу A". В то же время силы давления, A" действующие со стороны газа на поршень, совершают работу A = –A"
Термодинамика. Способы изменения внутренней энергии Внутренняя энергия тела может изменяться, если действующие на него внешние силы совершают работу (положительную или отрицательную). работу Например, если газ подвергается сжатию в цилиндре под поршнем, то внешние силы совершают над газом некоторую положительную работу A". В то же время силы давления, A" действующие со стороны газа на поршень, совершают работу A = –A"
 Термодинамика. Способы изменения внутренней энергии Внутренняя энергия тела может изменяться не только в результате совершаемой работы, но и вследствие теплообмена. При тепловом контакте тел внутренняя энергия одного из них может увеличиваться, а другого – уменьшаться. В этом случае говорят о тепловом потоке от одного тела к другому. Количеством теплоты Q, полученным телом, Количеством теплоты Q называют изменение внутренней энергии тела в результате теплообмена.
Термодинамика. Способы изменения внутренней энергии Внутренняя энергия тела может изменяться не только в результате совершаемой работы, но и вследствие теплообмена. При тепловом контакте тел внутренняя энергия одного из них может увеличиваться, а другого – уменьшаться. В этом случае говорят о тепловом потоке от одного тела к другому. Количеством теплоты Q, полученным телом, Количеством теплоты Q называют изменение внутренней энергии тела в результате теплообмена.
 Термодинамика. Способы изменения внутренней энергии Передача энергии от одного тела другому в форме тепла может происходить только при наличии разности температур между ними. Тепловой поток всегда направлен от горячего тела к холодному Количество теплоты Q является энергетической величиной. В СИ количество теплоты измеряется в единицах механической работы – джоулях (Дж).
Термодинамика. Способы изменения внутренней энергии Передача энергии от одного тела другому в форме тепла может происходить только при наличии разности температур между ними. Тепловой поток всегда направлен от горячего тела к холодному Количество теплоты Q является энергетической величиной. В СИ количество теплоты измеряется в единицах механической работы – джоулях (Дж).
 Термодинамика. Первый закон термодинамики На рис. условно изображены энергетические потоки между выделенной термодинамической системой и окружающими телами. Величина Q > 0, если тепловой Q > 0 поток направлен в сторону термодинамической системы. Величина A > 0, если система совершает положительную A > 0 работу над окружающими телами. Если система обменивается теплом с окружающими телами и совершает работу (положительную или отрицательную), то изменяется состояние системы, изменяется состояние системы т. е. изменяются ее макроскопические параметры (температура, давление, объем).
Термодинамика. Первый закон термодинамики На рис. условно изображены энергетические потоки между выделенной термодинамической системой и окружающими телами. Величина Q > 0, если тепловой Q > 0 поток направлен в сторону термодинамической системы. Величина A > 0, если система совершает положительную A > 0 работу над окружающими телами. Если система обменивается теплом с окружающими телами и совершает работу (положительную или отрицательную), то изменяется состояние системы, изменяется состояние системы т. е. изменяются ее макроскопические параметры (температура, давление, объем).
 Термодинамика. Первый закон термодинамики Так как внутренняя энергия U однозначно определяется макроскопическими параметрами, характеризующими состояние системы, то отсюда следует, что процессы теплообмена и совершения работы сопровождаются изменением ΔU внутренней энергии системы.
Термодинамика. Первый закон термодинамики Так как внутренняя энергия U однозначно определяется макроскопическими параметрами, характеризующими состояние системы, то отсюда следует, что процессы теплообмена и совершения работы сопровождаются изменением ΔU внутренней энергии системы.
 Термодинамика. Первый закон термодинамики Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом: Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами. ΔU = Q – A Соотношение, выражающее первый закон термодинамики, часто записывают в другой форме: Q = ΔU + A Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
Термодинамика. Первый закон термодинамики Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом: Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами. ΔU = Q – A Соотношение, выражающее первый закон термодинамики, часто записывают в другой форме: Q = ΔU + A Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
 Термодинамика. Первый закон термодинамики Применим первый закон термодинамики к изопроцессам в газах. В изохорном процессе (V = const) газ работы не совершает, A = 0. Следовательно, Q = ΔU = U (T 2) – U (T 1). Здесь U (T 1) и U (T 2) – внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит только от температуры (закон Джоуля). При изохорном нагревании тепло поглощается газом (Q > 0), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам (Q 0 – тепло поглощается газом, и газ совершает положительную работу. При изобарном сжатии Q
Термодинамика. Первый закон термодинамики Применим первый закон термодинамики к изопроцессам в газах. В изохорном процессе (V = const) газ работы не совершает, A = 0. Следовательно, Q = ΔU = U (T 2) – U (T 1). Здесь U (T 1) и U (T 2) – внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит только от температуры (закон Джоуля). При изохорном нагревании тепло поглощается газом (Q > 0), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам (Q 0 – тепло поглощается газом, и газ совершает положительную работу. При изобарном сжатии Q
 Тепловые двигатели. Термодинамические циклы. Цикл Карно Тепловым двигателем называется устройство, способное превращать полученное количество теплоты в механическую работу. Механическая работа в тепловых двигателях производится в процессе расширения некоторого вещества, которое называется рабочим телом. В качестве рабочего тела обычно используются газообразные вещества (пары бензина, воздух, водяной пар). Рабочее тело получает (или отдает) тепловую энергию в процессе теплообмена с телами, имеющими большой запас внутренней энергии. Эти тела называются тепловыми резервуарами. Реально существующие тепловые двигатели (паровые машины, двигатели внутреннего сгорания и т. д.) работают циклически. Процесс теплопередачи и преобразования полученного количества теплоты в работу периодически повторяется. Для этого рабочее тело должно совершать круговой процесс или термодинамический цикл, при котором периодически восстанавливается исходное состояние.
Тепловые двигатели. Термодинамические циклы. Цикл Карно Тепловым двигателем называется устройство, способное превращать полученное количество теплоты в механическую работу. Механическая работа в тепловых двигателях производится в процессе расширения некоторого вещества, которое называется рабочим телом. В качестве рабочего тела обычно используются газообразные вещества (пары бензина, воздух, водяной пар). Рабочее тело получает (или отдает) тепловую энергию в процессе теплообмена с телами, имеющими большой запас внутренней энергии. Эти тела называются тепловыми резервуарами. Реально существующие тепловые двигатели (паровые машины, двигатели внутреннего сгорания и т. д.) работают циклически. Процесс теплопередачи и преобразования полученного количества теплоты в работу периодически повторяется. Для этого рабочее тело должно совершать круговой процесс или термодинамический цикл, при котором периодически восстанавливается исходное состояние.
 Тепловые двигатели. Термодинамические циклы. Цикл Карно Общее свойство всех круговых процессов состоит в том, что их невозможно провести, приводя рабочее тело в тепловой контакт только с одним тепловым резервуаром. Их нужно, по крайней мере, два. Тепловой резервуар с более высокой температурой называют нагревателем, а с более низкой – холодильником. Совершая круговой процесс, рабочее тело получает от нагревателя некоторое количество теплоты Q 1 > 0 и отдает холодильнику количество теплоты Q 2
Тепловые двигатели. Термодинамические циклы. Цикл Карно Общее свойство всех круговых процессов состоит в том, что их невозможно провести, приводя рабочее тело в тепловой контакт только с одним тепловым резервуаром. Их нужно, по крайней мере, два. Тепловой резервуар с более высокой температурой называют нагревателем, а с более низкой – холодильником. Совершая круговой процесс, рабочее тело получает от нагревателя некоторое количество теплоты Q 1 > 0 и отдает холодильнику количество теплоты Q 2
 Тепловые двигатели. Термодинамические циклы. Цикл Карно Работа A, совершаемая рабочим телом за цикл, равна полученному за цикл количеству теплоты Q. Отношение работы A к количеству теплоты Q 1, полученному рабочим телом за цикл от нагревателя, называется коэффициентом полезного действия η тепловой машины:
Тепловые двигатели. Термодинамические циклы. Цикл Карно Работа A, совершаемая рабочим телом за цикл, равна полученному за цикл количеству теплоты Q. Отношение работы A к количеству теплоты Q 1, полученному рабочим телом за цикл от нагревателя, называется коэффициентом полезного действия η тепловой машины:
 Тепловые двигатели. Термодинамические циклы. Цикл Карно Коэффициент полезного действия указывает, какая часть тепловой энергии, полученной рабочим телом от «горячего» теплового резервуара, превратилась в полезную работу. Остальная часть (1 – η) была «бесполезно» передана холодильнику. (1 – η) Коэффициент полезного действия тепловой машины всегда меньше единицы (η 0, A > 0, Q 2 T 2
Тепловые двигатели. Термодинамические циклы. Цикл Карно Коэффициент полезного действия указывает, какая часть тепловой энергии, полученной рабочим телом от «горячего» теплового резервуара, превратилась в полезную работу. Остальная часть (1 – η) была «бесполезно» передана холодильнику. (1 – η) Коэффициент полезного действия тепловой машины всегда меньше единицы (η 0, A > 0, Q 2 T 2
 Тепловые двигатели. Термодинамические циклы. Цикл Карно В 1824 году французский инженер С. Карно рассмотрел круговой процесс, состоящий из двух изотерм и двух адиабат, который сыграл важную роль в развитии учения о тепловых процессах. Он называется циклом Карно (рис. 3. 11. 4).
Тепловые двигатели. Термодинамические циклы. Цикл Карно В 1824 году французский инженер С. Карно рассмотрел круговой процесс, состоящий из двух изотерм и двух адиабат, который сыграл важную роль в развитии учения о тепловых процессах. Он называется циклом Карно (рис. 3. 11. 4).
 Тепловые двигатели. Термодинамические циклы. Цикл Карно Цикл Карно совершает газ, находящийся в цилиндре под поршнем. На изотермическом участке (1– 2) газ приводится в тепловой контакт с горячим тепловым резервуаром (нагревателем), имеющим температуру T 1. Газ изотермически расширяется, совершая работу A 12, при этом к газу подводится некоторое количество теплоты Q 1 = A 12. Далее на адиабатическом участке (2– 3) газ помещается в адиабатическую оболочку и продолжает расширяться в отсутствие теплообмена. На этом участке газ совершает работу A 23 > 0. Температура газа при адиабатическом расширении падает до значения T 2. На следующем изотермическом участке (3– 4) газ приводится в тепловой контакт с холодным тепловым резервуаром (холодильником) при температуре T 2
Тепловые двигатели. Термодинамические циклы. Цикл Карно Цикл Карно совершает газ, находящийся в цилиндре под поршнем. На изотермическом участке (1– 2) газ приводится в тепловой контакт с горячим тепловым резервуаром (нагревателем), имеющим температуру T 1. Газ изотермически расширяется, совершая работу A 12, при этом к газу подводится некоторое количество теплоты Q 1 = A 12. Далее на адиабатическом участке (2– 3) газ помещается в адиабатическую оболочку и продолжает расширяться в отсутствие теплообмена. На этом участке газ совершает работу A 23 > 0. Температура газа при адиабатическом расширении падает до значения T 2. На следующем изотермическом участке (3– 4) газ приводится в тепловой контакт с холодным тепловым резервуаром (холодильником) при температуре T 2
 Необратимость тепловых процессов. Второй закон термодинамики. Первый закон термодинамики – закон сохранения энергии для тепловых процессов – устанавливает связь между количеством теплоты Q, полученной системой, изменением ΔU ее внутренней энергии и работой A, совершенной над внешними телами: Q = ΔU + A Согласно этому закону, энергия не может быть создана или уничтожена; она передается от одной системы к другой и превращается из одной формы в другую. Процессы, нарушающие первый закон термодинамики, никогда не наблюдались. На рис. изображены устройства, запрещенные первым законом термодинамики Циклически работающие тепловые машины, запрещаемые первым законом термодинамики: 1 – вечный двигатель 1 рода, совершающий работу без потребления энергии извне; 2 – тепловая машина с коэффициентом полезного действия η > 1
Необратимость тепловых процессов. Второй закон термодинамики. Первый закон термодинамики – закон сохранения энергии для тепловых процессов – устанавливает связь между количеством теплоты Q, полученной системой, изменением ΔU ее внутренней энергии и работой A, совершенной над внешними телами: Q = ΔU + A Согласно этому закону, энергия не может быть создана или уничтожена; она передается от одной системы к другой и превращается из одной формы в другую. Процессы, нарушающие первый закон термодинамики, никогда не наблюдались. На рис. изображены устройства, запрещенные первым законом термодинамики Циклически работающие тепловые машины, запрещаемые первым законом термодинамики: 1 – вечный двигатель 1 рода, совершающий работу без потребления энергии извне; 2 – тепловая машина с коэффициентом полезного действия η > 1
 Необратимость тепловых процессов. Второй закон термодинамики. Первый закон термодинамики не устанавливает направления тепловых Первый закон термодинамики процессов. Однако, как показывает опыт, многие тепловые процессы могут протекать только в одном направлении. Такие процессы называются необратимыми. Например, при тепловом контакте двух тел с разными температурами тепловой поток всегда направлен от более теплого тела к более холодному. Никогда не наблюдается самопроизвольный процесс передачи тепла от тела с низкой температурой к телу с более высокой температурой. Следовательно, процесс теплообмена при конечной разности температур является необратимым. Обратимыми процессами называют процессы перехода системы из одного равновесного состояния в другое, которые можно провести в обратном направлении через ту же последовательность промежуточных равновесных состояний. При этом сама система и окружающие тела возвращаются к исходному состоянию. Процессы, в ходе которых система все время остается в состоянии равновесия, называются квазистатическими. Все квазистатические процессы обратимы. Все обратимые процессы являются квазистатическими.
Необратимость тепловых процессов. Второй закон термодинамики. Первый закон термодинамики не устанавливает направления тепловых Первый закон термодинамики процессов. Однако, как показывает опыт, многие тепловые процессы могут протекать только в одном направлении. Такие процессы называются необратимыми. Например, при тепловом контакте двух тел с разными температурами тепловой поток всегда направлен от более теплого тела к более холодному. Никогда не наблюдается самопроизвольный процесс передачи тепла от тела с низкой температурой к телу с более высокой температурой. Следовательно, процесс теплообмена при конечной разности температур является необратимым. Обратимыми процессами называют процессы перехода системы из одного равновесного состояния в другое, которые можно провести в обратном направлении через ту же последовательность промежуточных равновесных состояний. При этом сама система и окружающие тела возвращаются к исходному состоянию. Процессы, в ходе которых система все время остается в состоянии равновесия, называются квазистатическими. Все квазистатические процессы обратимы. Все обратимые процессы являются квазистатическими.
 Необратимость тепловых процессов. Второй закон термодинамики. Процессы превращения механической работы во внутреннюю энергию тела являются необратимыми из-за наличия трения, процессов диффузии в газах и жидкостях, процессы перемешивания газа при наличии начальной разности давлений и т. д. Все реальные процессы необратимы, но они могут сколь угодно близко приближаться к обратимым процессам. Обратимые процессы являются идеализацией реальных процессов. Первый закон термодинамики не может отличить обратимые процессы от необратимых. Он просто требует от термодинамического процесса определенного энергетического баланса и ничего не говорит о том, возможен такой процесс или нет.
Необратимость тепловых процессов. Второй закон термодинамики. Процессы превращения механической работы во внутреннюю энергию тела являются необратимыми из-за наличия трения, процессов диффузии в газах и жидкостях, процессы перемешивания газа при наличии начальной разности давлений и т. д. Все реальные процессы необратимы, но они могут сколь угодно близко приближаться к обратимым процессам. Обратимые процессы являются идеализацией реальных процессов. Первый закон термодинамики не может отличить обратимые процессы от необратимых. Он просто требует от термодинамического процесса определенного энергетического баланса и ничего не говорит о том, возможен такой процесс или нет.
 Необратимость тепловых процессов. Второй закон термодинамики. Направление самопроизвольно протекающих процессов устанавливает второй закон термодинамики. Он может быть сформулирован в термодинамики виде запрета на определенные виды термодинамических процессов. Английский физик У. Кельвин дал в 1851 г. следующую формулировку второго закона: второго закона В циклически действующей тепловой машине невозможен процесс, единственным результатом которого было бы преобразование в механическую работу всего количества теплоты, полученного от единственного теплового резервуара.
Необратимость тепловых процессов. Второй закон термодинамики. Направление самопроизвольно протекающих процессов устанавливает второй закон термодинамики. Он может быть сформулирован в термодинамики виде запрета на определенные виды термодинамических процессов. Английский физик У. Кельвин дал в 1851 г. следующую формулировку второго закона: второго закона В циклически действующей тепловой машине невозможен процесс, единственным результатом которого было бы преобразование в механическую работу всего количества теплоты, полученного от единственного теплового резервуара.
 Необратимость тепловых процессов. Второй закон термодинамики. Немецкий физик Р. Клаузиус дал другую формулировку второго закона термодинамики: Невозможен процесс, единственным результатом которого была бы передача энергии путем теплообмена от тела с низкой температурой к телу с более высокой температурой. На рис. изображены процессы, запрещенные вторым законом, но не запрещенные первым законом термодинамики. Эти процессы соответствуют двум формулировкам второго закона термодинамики. 1 – вечный двигатель второго рода; 2 – самопроизвольный переход тепла от холодного тела к более теплому (идеальная холодильная машина)
Необратимость тепловых процессов. Второй закон термодинамики. Немецкий физик Р. Клаузиус дал другую формулировку второго закона термодинамики: Невозможен процесс, единственным результатом которого была бы передача энергии путем теплообмена от тела с низкой температурой к телу с более высокой температурой. На рис. изображены процессы, запрещенные вторым законом, но не запрещенные первым законом термодинамики. Эти процессы соответствуют двум формулировкам второго закона термодинамики. 1 – вечный двигатель второго рода; 2 – самопроизвольный переход тепла от холодного тела к более теплому (идеальная холодильная машина)
По онлайн-курсу возможно получение сертификата.
В курсе рассматриваются ключевые понятия и методы термодинамики и молекулярной физики как части курса общей физики, читаемого студентам Московского Физико-Технического Института. Прежде всего, вводятся основные термодинамические величины, понятия и постулаты. Рассматриваются основные термодинамические соотношения. Отдельные лекции посвящены теории фазовых переходов, модели газа Ван-Дер-Ваальса, поверхностным явлениям. Даются основные понятия статистической физики: микро- и макро состояние системы, статистическая сумма, функции распределения и др. Обсуждаются распределения Максвелла, Больцмана, Гибсса. Излагаются элементы теории теплоемкости газов. Выводятся выражения для флуктуаций основных термодинамических величин. Дается описание молекулярных процессов в газах: процессов переноса, диффузии и теплопроводности.
О курсе
Онлайн-курс содержит в себе обсуждение базовых физических вопросов, разбор задач, демонстрации физических экспериментов, без которых невозможно глубокое понимание общей физики. Для успешного освоения онлайн-курса слушателю желательно знать курс общей физики: "Механика" и владеть основами математического анализа, знать основы линейной алгебры и теории вероятностей.
Формат
Онлайн-курс содержит в себе теоретический материал, демонстрации ключевых термодинамических экспериментов, необходимые для правильного понимания явлений, разборы решений типовых задач, упражнения и задачи для самостоятельного решения
Седьмая, тринадцатая и восемнадцатая недели содержат контрольные задания для проверки.
Программа курса
Неделя 1
Основные понятия молекулярной физики и термодинамики: предмет исследования, его характерные особенности. Задачи молекулярной физики. Уравнения состояния. Давление идеального газа как функция кинетической энергии молекул. Соотношение между температурой идеального газа и кинетической энергией его молекул. Законы идеальных газов. Уравнения состояния идеального газа. Квазистатические, обратимые и необратимые термодинамические процессы. Нулевое начало термодинамики. Работа, теплота, внутренняя энергия. Первое начало термодинамики. Теплоёмкость. Теплоёмкость идеальных газов при постоянном объёме и постоянном давлении, уравнение Майера. Адиабатический и политропический процессы. Уравнение политропы для идеального газа. Адиабатический и политропический процессы. Независимость внутренней энергии идеального газа от объёма.
Неделя 2
Второе начало термодинамики. Формулировки второго начала. Тепловая машина. Определение КПД тепловой машины. Цикл Карно. Теорема Карно. Неравенство Клаузиуса. Максимальность КПД цикла Карно по сравнению с другими термодинамическими циклами. Холодильная машина. Эффективность холодильной машины. Тепловой насос. Эффективность теплового насоса, работающего по циклу Карно. Связь между коэффициентами эффективности теплового насоса и холодильной машины.
Неделя 3
Термодинамическое определение энтропии. Закон возрастания энтропии. Энтропия идеального газа. Энтропия в обратимых и необратимых процессах. Адиабатическое расширение идеального газа в вакуум. Объединённое уравнение первого и второго начал термодинамики. Третье начало термодинамики. Изменение энтропии и теплоёмкости при приближении температуры к абсолютному нулю.
Неделя 4
Термодинамические функции. Свойства термодинамических функций. Максимальная и минимальная работа. Преобразования термодинамических функций. Соотношения Максвелла. Зависимость внутренней энергии от объёма. Зависимость теплоёмкости от объёма. Соотношение между СP и СV. Теплофизические свойства твёрдых тел. Термодинамика деформации твёрдых тел. Изменение температуры при адиабатическом растяжении упругого стержня. Тепловое расширение как следствие ангармоничности колебаний в решётке. Коэффициент линейного расширения стержня.
Неделя 5
Условия термодинамического равновесия. Фазовые превращения. Фазовые переходы I и II рода. Химический потенциал. Условие равновесия фаз. Кривая фазового равновесия. Уравнение Клапейрона–Клаузиуса. Диаграмма состояния двухфазной системы «жидкость–пар». Зависимость теплоты фазового перехода от температуры. Критическая точка. Тройная точка. Диаграмма состояния «лёд–вода–пар». Поверхностные явления. Термодинамика поверхности. Свободная энергия поверхности. Краевые углы. Смачивание и несмачивание. Формула Лапласа. Зависимость давления пара от кривизны поверхности жидкости. Кипение. Роль зародышей при образовании новой фазы.
Неделя 6
Газ Ван-дер-Ваальса как модель реального газа. Изотермы газа Ван-дер-Ваальса. Метастабильные состояния. Перегретая жидкость и переохлаждённый пар. Правило Максвелла и правило рычага. Критические параметры и приведённое уравнение состояния газа Ван-дер-Ваальса. Внутренняя энергия газа Ван-дер-Ваальса. Уравнение адиабаты газа Ван-дер-Ваальса. Энтропия газа Ван-дер-Ваальса. Скорость звука в газах. Скорость истечения газа из отверстия. Эффект Джоуля–Томсона. Адиабатическое расширение, дросселирование. Получение низких температур.
Неделя 7
Проверочная
Неделя 8
Динамические и статистические закономерности. Макроскопические и микроскопические состояния. Фазовое пространство. Элементы теории вероятностей. Условие нормировки. Средние величины и дисперсия. Биномиальный закон распределения. Распределение Пуассона. Распределение Гаусса.
Неделя 9
Распределения Максвелла. Распределение частиц по компонентам скорости и абсолютным значениям скорости. Наиболее вероятная, средняя и среднеквадратичная скорости. Распределения Максвелла по энергиям. Среднее число ударов молекул, сталкивающихся в единицу времени с единичной площадкой. Средняя энергия молекул, вылетающих в вакуум через малое отверстие в сосуде.
Неделя 10
Распределение Больцмана в однородном поле сил. Барометрическая формула. Микро- и макросостояния. Статистический вес макросостояния. Статистическое определение энтропии. Энтропия при смешении газов. Парадокс Гиббса. Представление о распределении Гиббса. Статистическая сумма и её использование для нахождения внутренней энергии. Статистическая температура.
Неделя 11
Флуктуации. Средние значения энергии и дисперсии (среднеквадратичной флуктуации) энергии частицы. Флуктуации термодинамических величин. Флуктуация температуры в фиксированном объёме. Флуктуация объёма в изотермическом и адиабатическом процессах. Флуктуации аддитивных физических величин. Зависимость флуктуаций от числа частиц, составляющих систему.
Неделя 12
Теплоёмкость. Классическая теория теплоёмкостей. Закон равномерного распределения энергии теплового движения по степеням свободы. Теплоёмкость кристаллов (закон Дюлонга–Пти). Элементы квантовой теории теплоёмкостей. Характеристические температуры. Зависимость теплоёмкости от температуры.
Неделя 13
Столкновения. Эффективное газокинетическое сечение. Длина свободного пробега. Распределение молекул по длинам свободного пробега. Число столкновений молекул между собой. Явления переноса: вязкость, теплопроводность и диффузия. Законы Фика и Фурье. Коэффициенты вязкости, теплопроводности и диффузии в газах.
Неделя 14
Броуновское движение. Подвижность. Закон Эйнштейна–Смолуховского. Связь подвижности частицы и коэффициента диффузии. Явления переноса в разрежённых газах. Эффект Кнудсена. Эффузия. Течение разрежённого газа через прямолинейную трубу.
Неделя 15
Проверочная
Результаты обучения
В результате изучения дисциплины «Термодинамика» обучающийся должен:
- Знать:
- основные понятия, используемые в молекулярной физике, термодинамике;
- смысл физических величин, используемых в молекулярной физике, термодинамике;
- уравнения состояния идеального газа и газа Ван-дер-Ваальса;
- распределения Больцмана и Максвелла, закон равномерного распределения энергии по степеням свободы;
- нулевое, первое, второе и третье начала термодинамики, неравенство Клаузиуса, закон возрастания энтропии;
- условия устойчивого термодинамического равновесия;
- уравнение Клапейрона-Клаузиуса;
- формулу Лапласа;
- уравнения, описывающие процессы переноса (диффузии, вязкости,теплопроводности);
- Уметь:
- использовать основные положения молекулярно-кинетической теории газов для решения задач;
- использовать законы молекулярной физики и термодинамики при описании равновесных состояний тепловых процессов и процессов переноса;
- Владеть:
- методами расчёта параметров состояния вещества;
- методами расчёта работы, количества теплоты и внутренней энергии;
Формируемые компетенции
- способность анализировать научные проблемы и физические процессы, использовать на практике фундаментальные знания, полученные в области естественных наук (ОК-1)
- способность осваивать новые проблематику, терминологию, методологию и овладевать научными знаниями, владением навыками самостоятельного обучения (ОК-2)
- способность применять в своей профессиональной деятельности знания,полученные в области физических и математических дисциплин (ПК-1)
- способность понимать сущность задач, поставленных в ходе профессиональной деятельности, и использовать соответствующий физико-математический аппарат для их описания и решения (ПК-3)
- способность использовать знания в области физических и математических дисциплин для дальнейшего освоения дисциплин в соответствии с профилем подготовки (ПК-4)
- способность применять теорию и методы математики, физики и информатики для построения качественных и количественных моделей (ПК-8)
ПРЕДИСЛОВИЕ
Молекулярная физика и термодинамика на фундаментальном уровне изучают общее понятие об энергии и ее превращениях, свойства и особенности вещества в различных условиях. Рассмотрение вопросов такого рода закладывает основу для освоения общетехнических и специальных дисциплин. В будущей практической деятельности выпускника вуза эти знания и навыки должны помочь в постановке и решении инженерных задач, а также освоении новых видов техники и оборудования.
В соответствии с этим, в учебном пособии последовательно вводятся основные понятия и величины, характеризующие тепловые явления, а также взаимосвязь между ними. Рассмотрены особенности классической статистики, распределение Максвелла-Больцмана, явления переноса, понятие квантовой электроники и плазмы, фазовых превращений.
На основе первого и второго начал рассмотрены основы термодинамики.
Текст сопровождается примерами решения задач по соответствующим темам.
В приложении приведены физические постоянные, некоторые математические соотношения, а также вопросы и задачи для проведения коллоквиумов или самостоятельной работы студентов.
Отсутствующий здесь материал, связанный с квантовой статистикой и физикой твердого тела имеется в ранее опубликованном нами пособии (3).
В пособии используется стандартная система единиц СИ, хотя в примерах даются нестандартные единицы (кал, атм, мм. рт. ст. и др.).
ВВЕДЕНИЕ
МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА
Молекулярная физика - раздел физики, изучающий строение и свойства вещества, исходя из вытекающих из опыта представлений о том, что любое тело состоит из большого числа частиц (атомов или молекул), находящихся в непрерывном хаотическом тепловом движении . В механике движение тела однозначно определяется начальными условиями и силами, действующими на тело. Зная эти величины, можно вычислить положение тела в любой момент времени. Такие явления описываются динамическими закономерностями. В молекулярной физике рассматриваются явления, вызванные действием огромного числа частиц. При движении такого огромного числа частиц, координаты и скорости которых постоянно меняются, рассчитать движение каждого из огромного числа атомов или молекул невозможно даже на компьютере, поэтому в данном случае проявляются вероятностные или статистические закономерности, изучаемые методами статистической физики. Это означает, что законы молекулярной физики нельзя свести к законам механики. В статистической физике рассматривается конкретная молекулярная модель и к ней применяются математические методы статистики и теории вероятностей. Следовательно, для исследования используется статистический метод.
Статистический метод основан на законах теории вероятностей и математической статистики.
Статистическая физика рассматривает равновесное состояние - состояние, при котором макроскопические параметры не меняются со временем.
Методами статистической физики изучается, например, диффузия, теплопроводность, теплоемкость - явления, которые полностью определяются строением вещества. Макроскопические процессы в телах, состоящих из большого числа частиц, изучает так же термодинамика.
Термодинамика - раздел физики, изучающий связь и взаимопревращения различных видов энергии, теплоты и работы.
Термодинамика не рассматривает конкретные молекулярные модели. На основе опытных данных формулируются основные законы или начала термодинамики. Эти законы и следствия из них применяются к конкретным физическим явлениям, связанным с макроскопическими превращениями энергии, т.е. не с процессами, происходящими с отдельными атомами и молекулами, а с телами, состоящими из очень большого числа частиц.
Таким образом, предмет у термодинамики и статистической физики один и тот же, различаются лишь методы, которые взаимно дополняют друг друга.
Термодинамика рассматривает термодинамические системы . Системой называют совокупность физических объектов, заключенных в конечной области пространства. Термодинамической системой называется совокупность макроскопических тел и полей, обменивающихся энергией и веществом друг с другом и с внешней средой. Система может состоять и из одного тела. Признаки, характеризующие систему, например, давление, температура, плотность и ряд других, называются термодинамическими параметрами или параметрами состояния. Обычно подбирается минимальное число параметров, которые полностью описывают состояние системы.
Различают экстенсивные параметры, величины которых, завися от количества вещества и интенсивные параметры, величины которых, не зависят от количества вещества. Примером экстенсивной величины является энергия, интенсивной - плотность, температура. Обычно экстенсивные параметры обозначают прописными буквами, а интенсивные - строчными.
Совокупность всех термодинамических параметров задает термодинамическое состояние системы. Уравнение состояния связывает минимальное число термодинамических параметров, необходимое для описания как самого состояния системы, так и других параметров. Термодинамический метод основан на определении состояния термодинамической системы.
Статистические и термодинамические методы являются эффективными методами исследования любых систем, состоящих из большого числа частиц, а не только молекулярных систем. Это означает, что эти методы являются общефизическими методами исследования, а молекулярная физика выступает лишь в качестве одной из областей их применения.